
分析 发生3H2+N2?2NH3,设参加反应的氮气的物质的量为x,则
3H2+N2?2NH3
开始 3 1 0
转化 3x x 2x
3min 3-3x 1-x 2x
3min后测得密闭容器内的压强是起始时的0.9倍,则$\frac{3-3x+1-x+2x}{3+1}$=0.9,
解得x=0.2,
结合v=$\frac{△c}{△t}$、转化率=$\frac{转化的量}{开始的量}$×100%计算.
解答 解:发生3H2+N2?2NH3,设参加反应的氮气的物质的量为x,则
3H2+N2?2NH3
开始 3 1 0
转化 3x x 2x
3min 3-3x 1-x 2x
3min后测得密闭容器内的压强是起始时的0.9倍,则$\frac{3-3x+1-x+2x}{3+1}$=0.9,
解得x=0.2,
(1)此时间段内H2的反应速率是$\frac{\frac{0.2mol×3}{2L}}{3min}$=0.1mol/(L.min),答:H2的反应速率是0.1mol/(L.min);
(2)3分钟后N2的转化率为$\frac{0.2mol}{1mol}$×100%=20%,答:N2的转化率为20%;
(3)反应3分钟后N2的物质的量分数为$\frac{1-0.2}{4-0.2×2}$×100%=22.2%,答:3分钟后N2的物质的量分数为22.2%.
点评 本题考查化学平衡的计算,为高频考点,把握化学平衡三段法、反应速率及转化率的计算为解答的关键,侧重分析与计算能力的考查,注意物质的量比等于压强比,题目难度不大.


科目:高中化学 来源: 题型:实验题
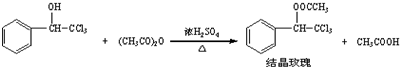
| 三氯甲基苯基甲醇 | 无色液体.不溶于水,溶于乙醇. |
| 醋酸酐 | 无色液体.溶于水形成乙酸,溶于乙醇. |
| 结晶玫瑰 | 白色至微黄色晶体.不溶于水,溶于乙醇.熔点:88℃ |
| 醋酸 | 无色的吸湿性液体,易溶于水、乙醇. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能(KJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15399 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
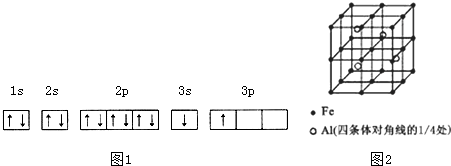
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
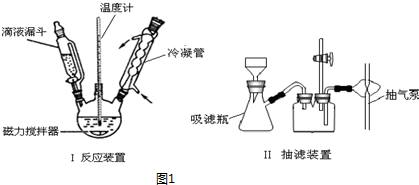
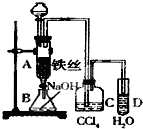 某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.
某化学课外小组用如图装置制取溴苯.先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 升高温度 | C. | 增大CH4浓度 | D. | 更换高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
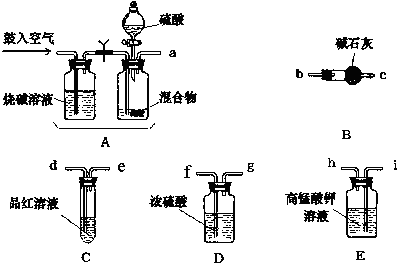
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只由一种元素的阳离子与另一种元素的阴离子组成的物质不一定是纯净物 | |
| B. | 用加热的方法可以除去混在NaCl固体中的NH4Cl,说明NH4Cl会升华 | |
| C. | SO2气体和Cl2均能使品红溶液褪色,说明两者均有强氧化性 | |
| D. | 浓硫酸不能用来干燥HI、CO、SO2等气体,因为浓硫酸具有强氧化性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com