
| A、硅原子和钠原子 |
| B、硼原子和氦原子 |
| C、氯原子和碳原子 |
| D、碳原子和铝原子 |
| 1 |
| 2 |
| 1 |
| 2 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | a中试剂 | b中试剂 | 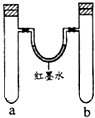 |
| 1 | 0.1克Na、3mL水 | 0.1克Na、3mL乙醇 | |
| 2 | 3mL水 | 3mL饱和FeSO4溶液 | |
| 3 | 3mL浓硝酸、1g铝片 | 3mL浓硝酸、1g铜片 | |
| 4 | 生铁钉、3mL饱和食盐水 | 生铁钉、3mL饱和氯化铵 |
查看答案和解析>>
科目:高中化学 来源: 题型:
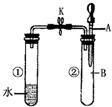 如图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾.则A与B可能是( )
如图所示,试管①中盛有96℃的水,试管②中充满气体 B,将液体A滴入试管②中,充分反应后打开夹子K,发现试管①中的水立刻沸腾.则A与B可能是( )| A、水与氮气 |
| B、稀硫酸与一氧化碳 |
| C、浓氢氧化钠溶液与二氧化碳 |
| D、饱和食盐水与氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
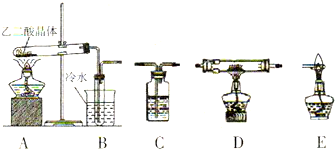
| 装置编号 | 装置中所加物质 | 装置作用 |
| B | -------- | |
| C | ||
| C | 氢氧化钠浓溶液 | |
| C | ||
| D | ||
| E | -------- |
查看答案和解析>>
科目:高中化学 来源: 题型:
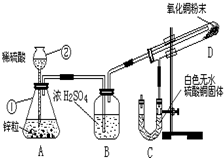 某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有大量Fe3+的溶液中:NH4+、Na+、Cl-、CO32- |
| B、在强碱溶液中:Na+、K+、AlO2-、CO32- |
| C、在NH4+的溶液中:SiO32-、K+、SO42-、NO3- |
| D、在HCO3-的溶液中:K+、Na+、AlO2-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、减小压强 |
| B、缩小体积 |
| C、降低温度 |
| D、增大H2的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com