
| A. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 | |
| B. | 家庭用的“84”消毒液与洁厕灵能混合使用,不会发生中毒事故 | |
| C. | 可用蘸有浓氨水的玻璃棒检验输送氯气的管道是否漏气 | |
| D. | 硅胶可用作食品干燥剂 |
分析 A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液;
B.盐酸与次氯酸反应生成氯气;
C.NH3能与Cl2反应生成NH4Cl,该物质是一种白色固体物质;
D.硅胶具有吸水性,无毒.
解答 解:A.明矾溶液中Al3+水解使溶液呈酸性,铜锈为Cu2(OH)2CO3,溶于酸性溶液,故利用明矾溶液的酸性清除铜镜表面的铜锈,故A正确;
B.洁厕灵(有效成分为HCl)与84消毒液(有效成分为NaClO)混合使用发生氧化还原反应生成氯气,容易引起中毒,故B错误;
C.NH3是碱性气体,可以与Cl2反应生成NH4Cl,该物质是一种白色固体物质,可根据是否冒白烟用浓氨水检验输送氯气的管道是否有泄漏,故C正确;
D.硅胶具有吸水性,无毒,则硅胶可用作食品干燥剂,故D正确.
故选B.
点评 本题考查化学与生产、生活的关系,题目难度不大,要求学生能够用化学知识解释化学现象,试题培养了学生的分析、理解能力及灵活应用基础知识的能力.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6g石墨中的共价键数目 | |
| B. | 常温常压下,17g ND3中所含分子数目 | |
| C. | 0.1mol羟基(-OH)中所含电子数目 | |
| D. | 向0.2mol NH4Al(SO4)2溶液中滴加NaOH溶液至沉淀完全溶解,消耗的OH-数目 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | NH4++H2O?NH3•H2O+H+ | |
| B. | Al3++3H2O?Al(OH)3+3H+ | |
| C. | CH3COO-+NH4++H2O?CH3COOH+NH3•H2O | |
| D. | HCO3-+H2O?H3O++CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl | B. | Mg(HCO3)2 | C. | H2SO4 | D. | MgCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若x=4,则W的转化率增大 | B. | 若x=3,则W的转化率不变 | ||
| C. | 若W的转化率增大,则x一定等于1 | D. | 缺条件,无法判断 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
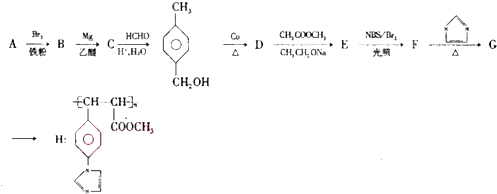



 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L CH3COOH溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(OH-)>c(H+)+c(CH3COOH) | |
| B. | 室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中:c(Cl-)>c(H+)>c(NH4+ )>c(OH-) | |
| C. | 20ml 0.1mol/L CH3COONa溶液与10ml HCl溶液混合后溶液呈酸性,所得溶液中:c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+)>c(OH-) | |
| D. | 0.1mol/L NaHCO3溶液与0.1mol/L NaOH溶液等体积混合,所得溶液中:c(Na+)>c(CO32-)>c(HCO3- )>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.
四种常见元素的性质或结构信息如下表,试根据信息回答有关问题.| 元素 | A | B | C | D |
| 性质 结构 信息 | 原子核外有两个电子层,最外层有3个未成对的电子 | 原子的M层有1对成对的p电子 | 原子核外电子排布为[Ar]3d104sx, 有+1、+2两种常见化合价 | 有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
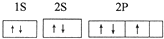
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com