
【题目】化学反应原理对化学反应的研究具有指导意义.
(1)298K,101KPa时,在1L水中可溶解0.09mol氯气,实验测得溶于说的氯气约有 ![]() 与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
与水反应,该反应的离子方程式为,在上述平衡体系中加入少量NaHCO3固体,溶液中c(H+),c(Cl﹣)(填“增大”、“减小”、“不变”)
(2)用水稀释0.1mol/L氨水,溶液中随着水量的增加而增大的是(填字母)
a.c(OH﹣) b.c(NH3H2O) c.c(NH4+)c(OH﹣)
d.NH3H2O的电离程度 e.溶液的导电性
当溶液适当升高温度(不考虑NH3H2O分解和NH3逸出),上述数据增大的是;在溶液中加入少量NH4Cl固体(不考虑溶液温度变化),上述数据增大的是;当加入少量NaOH固体(不考虑溶液温度变化),上述数据增大的是 .
【答案】
(1)增大
(2)d;a、c、d、e;b、e;a、b、e
【解析】解:(1)氯气与水反应生成盐酸和次氯酸,反应的离子方程式为:Cl2+H2OH++Cl﹣+HClO;在上述平衡体系中加入NaHCO3 , 溶液中的碳酸氢根离子,和氢离子反应,氢离子的浓度减小,平衡正向进行,溶液中Cl﹣浓度增大;所以答案是:Cl2+H2OH++Cl﹣+HClO;减小;增大;(2)随水的加入a.c(OH﹣)减小; b.c(NH3H2O)减小; c.c(NH4+)c(OH﹣)不变; d.NH3H2O的电离程度增大; e.溶液的导电性减弱;所以溶液中随着水量的增加而增大的是NH3H2O的电离程度,当溶液适当升高温度促进电离,上述数据增大的是c(OH﹣)、c(NH4+)c(OH﹣)、NH3H2O的电离程度、溶液的导电性都增强;在溶液中加入少量NH4Cl固体(不考虑溶液温度变化),电离平衡逆向移动,所以c(NH3H2O)、溶液的导电性都增强;当加入少量NaOH固体(不考虑溶液温度变化),氨水的电离平衡逆向移动,导致c(OH﹣)、c(NH3H2O)、溶液的导电性都增强,故选:d;a、c、d、e;b、e;a、b、e.
【考点精析】关于本题考查的化学平衡状态本质及特征,需要了解化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)才能得出正确答案.


科目:高中化学 来源: 题型:
【题目】下列四个试管中,发生如下反应:Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是( )
试管 | 盐酸浓度 | 温度 | 锌的状态 |
A | 0.5molL﹣1 | 20℃ | 块 状 |
B | 0.5molL﹣1 | 20℃ | 粉末状 |
C | 2molL﹣1 | 35℃ | 块 状 |
D | 2molL﹣1 | 35℃ | 粉末状 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是(NA表示阿伏加德罗常数的量)( )
A. 在常温常压下, ![]() 氧气和臭氧组成的混合气体中所含氧原子数目为NA
氧气和臭氧组成的混合气体中所含氧原子数目为NA
B. 1mol![]() (碳正离子)中含电子数目为10NA
(碳正离子)中含电子数目为10NA
C. 标准状况下,22.4LSO3中含有的氧原子数为3NA
D. 200mL 0.5mol/L硝酸铵溶液中含有![]() 0.1NA
0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCO3与砂搪混用可以作补血剂,实验室里制备FeCO3的流程如图所示。
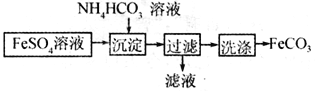
下列说法错误的是
A. 降低温度防止NH4HCO3和FeSO4分解
B. 沉淀过程中有CO2气体放出
C. 过滤操作的常用玻璃仪器有烧杯、漏斗和玻璃棒
D. 产品FeCO3在空气中高温分解可得到纯净的FeO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢叠氮酸(HN3)及其盐(如NaN3、NH4N3、CuN3等)都具有爆炸性,最近南京理工大学胡丙成教授团队成功合成出PHAC,其化学式为(N3)6(H3O)3(NH4)4Cl。回答下列问题:
(1)PHAC中“N3”的化合价为______。N2F2的电子式为_______。
(2)汽车安全气囊中的NaN3可发生下列反应:
NaN3(s)=Na(s)+3/2N2(g) △H1;
2NaN3(s)+CuO(s)=Na2O(s)+3N2(g)+Cu(s) △H1;
则反应CuO(s)+2Na(s)=Na2O(s)+Cu(s) △H=_______(用△H1和△H2表示)
(3)25℃时,将lmolNH4N3投入一2L的恒容密闭容器中,0.5min后反应达到平衡,测得生成的两种单质的物质的量之和为1.6mol, 则NH4N3的平衡转化率为_______,25℃时该反应的平衡常数K=________。
(4)氢叠氮酸(HN3)易溶于水,且酸性与醋酸相近。
①HN3在水溶液中的电离方程式为_______________.
② 0.1mol/L的HN3溶液与0.1mol/L的NaN3等体积混合,混合溶液中各离子浓度由大到小的顺序为__________________。
③ 已知T℃时,Ksp(CuN3)=5.0×10-9,Ksp(Cu2S)=2.5×10-48,则相同温度下反应:
Cu2S(s)+2N3-(aq)![]() 2CuN3(s)+S2-(aq)的平衡常数K=_________.
2CuN3(s)+S2-(aq)的平衡常数K=_________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这三种物质都正确的是 ( )
A.①AgNO3;②NaBr;③AgBr B.①AgNO3;②NaCl;③AgCl
C.①AgCl; ②AgNO3;③NaCl D.①AgNO3;②NaCl;③Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能源与能量的说法正确的是( )
A.煤和石油是经过亿万年形成的,亿万年后煤和石油还会生成,故二者属可再生能源
B.蒸汽属于一次能源
C.凡经过加热而发生的反应都是吸热反应,常温下进行的反应都是放热反应
D.反应物和生成物的总能量决定反应是放热还是吸热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 不溶于水和稀硫酸,制取流程如下:
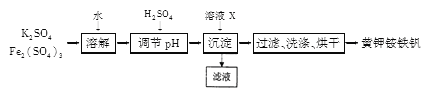
请回答下列问题:
(1)溶液X是_______。
(2)在黄钾铵铁矾[KNH4Fex(SO4)y(OH)z] 中,x、y、z的代数关系式为_______。
(3)检验滤液中是否存 在K+的操作是_______。
(4)黄钾铵铁矾的化学式可通过下列实验测定:
步骤1: 称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶配制成100.00mL 溶液A。
步骤2: 最取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g。
步骤3: 量取25.00mL溶液A,加入足最NaOH溶液,加热,收集到标准状下气体224mL,同时有红褐色沉淀生成。
步骤4: 将步骤3所得沉淀过滤、洗涤、灼烧,最终得固体4.80g。
①步骤1配制溶液A所需的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还需_______。
②根据以上实验数据计算黄钾铵铁矾中的n(OH-)∶n(SO42-)的比值为_______。(写出必要的计算过程,否则不得分)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com