
【题目】聚合硫酸铁(PFS)是一种高效的无机高分子絮凝剂。某工厂利用经浮选的硫铁矿烧渣(有效成分为Fe2O3 和Fe3O4)制备PFS,其工艺流程如下图所示。

(1)还原焙烧过程中,CO还原Fe3O4生成FeO的热化学方程式为________________________。
已知: Fe3O4(s)+C(s)= 3FeO(s)+CO(g) ΔH1=+191.9kJ·mol-1
C(s)+O2(g)=CO2(g) ΔH2=-393.5kJ·mol-1
C(s)+CO2(g)=2CO(g) ΔH3=+172.5kJ·mol-1
(2)CO是还原焙烧过程的主要还原剂。下图中,曲线表示4个化学反应a、b、c、d达到平衡时气相组成和温度的关系,I、Ⅱ、Ⅲ、Ⅳ分别是Fe2O3、Fe3O4、FeO、Fe稳定存在的区域。a属于_________(填“吸热反应”或“放热反应”);570℃时,d反应的平衡常数K= ____________。

(3)工业上,还原焙烧的温度一般控制在800℃左右,温度不宜过高的理由是___________________。
(4)若“酸浸”时间过长,浸出液中Fe2+含量反而降低,主要原因是___________________________。
(5)FeSO4溶液在空气中会缓慢氧化生成难溶的Fe(OH)SO4,该反应的离子方程式为_____________________________。“催化氧化”过程用NaNO2作催化剂(NO起实质上的催化作用)时,温度与Fe2+转化率的关系如右图所示(反应时间相同),Fe2+转化率随温度的升高先上升后下降的原因是___________________________________________________。

【答案】 Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19.4kJ·mol-1 放热反应 1 浪费能量,且FeO易被还原成Fe Fe2+易被空气中的O2氧化成Fe3+ 4SO42-+ 4Fe2++O2+2H2O=4Fe(OH)SO4↓ 温度升高,反应速率增大;温度过高,NO气体逸出,转化率下降
【解析】试题分析:(1)根据盖斯定律计算CO还原Fe3O4生成FeO的焓变;(2)根据图像,升高温度,Fe3O4的含量减小,反应a逆向移动;d反应的平衡常数K=![]() ;(3)温度大于800℃,FeO易被还原成Fe;(4)Fe2+易被空气中的O2氧化成Fe3+;(5)FeSO4溶液在空气中被氧气氧化生成难溶的Fe(OH)SO4,根据得失电子守恒、电荷守恒配平离子方程式;NO起实质上的催化作用,温度升高,反应速率增大;温度过高,NO气体逸出,转化率下降。
;(3)温度大于800℃,FeO易被还原成Fe;(4)Fe2+易被空气中的O2氧化成Fe3+;(5)FeSO4溶液在空气中被氧气氧化生成难溶的Fe(OH)SO4,根据得失电子守恒、电荷守恒配平离子方程式;NO起实质上的催化作用,温度升高,反应速率增大;温度过高,NO气体逸出,转化率下降。
解析:(1)①Fe3O4(s)+C(s)= 3FeO(s)+CO(g) ΔH1=+191.9kJ·mol-1
②C(s)+CO2(g)=2CO(g) ΔH3=+172.5kJ·mol-1
根据盖斯定律①-②,得Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+19.4kJ·mol-1。(2)根据图像,升高温度,Fe3O4的含量减小,反应a逆向移动,反应a放热;d反应的平衡常数K=![]() ,570℃时,CO、CO2浓度相等,所以K=1;(3)温度大于800℃,FeO易被还原成Fe,且浪费能量,所以工业上,还原焙烧的温度一般控制在800℃左右;(4)Fe2+易被空气中的O2氧化成Fe3+,所以“酸浸”时间过长,浸出液中Fe2+含量降低;(5)FeSO4溶液在空气中被氧气氧化生成难溶的Fe(OH)SO4,根据得失电子守恒、电荷守恒配平离子方程式为4SO42-+ 4Fe2++O2+2H2O=4Fe(OH)SO4↓;NO起实质上的催化作用,温度升高,反应速率增大;温度过高,NO气体逸出,转化率下降,所以Fe2+转化率随温度的升高先上升后下降。
,570℃时,CO、CO2浓度相等,所以K=1;(3)温度大于800℃,FeO易被还原成Fe,且浪费能量,所以工业上,还原焙烧的温度一般控制在800℃左右;(4)Fe2+易被空气中的O2氧化成Fe3+,所以“酸浸”时间过长,浸出液中Fe2+含量降低;(5)FeSO4溶液在空气中被氧气氧化生成难溶的Fe(OH)SO4,根据得失电子守恒、电荷守恒配平离子方程式为4SO42-+ 4Fe2++O2+2H2O=4Fe(OH)SO4↓;NO起实质上的催化作用,温度升高,反应速率增大;温度过高,NO气体逸出,转化率下降,所以Fe2+转化率随温度的升高先上升后下降。


科目:高中化学 来源: 题型:
【题目】下列有关物质应用的说法正确的是
A. 生石灰用作食品抗氧化剂
B. 氢氟酸能与SiO2反应,故可用氢氟酸在玻璃上蚀刻标记
C. 铝罐可久盛咸的食物
D. 苏打是面包发酵粉的主要成分之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾是含有一定量结晶水的硫酸亚铁(FeSO4·XH2O),在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。

①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却至室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。若实验时按a、d次序操作,则使x__________(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。C、D中的溶液依次为BaCl2溶液、浓H2SO4。C、D中有气泡冒出,并可观察到的现象分别为产生白色沉淀、品红溶液褪色。写出硫酸亚铁高温分解反应的化学方程式_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298K、1.01×105Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式正确的是

A. Se(s)+ H2(g) = H2Se(g) ΔH=-242kJ·mol-1
B. Se(s)+ H2(g) = H2Se(g) ΔH=-20kJ·mol-1
C. Se(g)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
D. Se(s)+ H2(g) = H2Se(g) ΔH=+81kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5mol/L盐酸0.14L恰好完全反应,所得溶液还能吸收标准状况下2.24L氯气,使其中Fe2+全部转化为Fe3+.该样品可能的化学式是( )
A. Fe5O6 B. Fe3O4 C. Fe6O7 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家最近研制出可望成为高效火箭推进剂的N(NO2)3(如图所示).已知该分子中N﹣N﹣N键角都是108.1°,下列有关N(NO2)3的说法正确的是 ( )
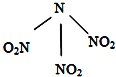
A. 分子中N、O间形成的共价键是非极性键
B. 15.2g该物质含有6.02×1022个原子
C. 分子中四个氮原子共平面
D. 该物质既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求写出下列反应的方程式:
(1)Al粉和NaOH溶液反应的化学方程式:_____
(2)漂白粉露置于空气中较长时间后失效的化学方程式:_____
(3)铁粉和水蒸气反应化学方程式:_____
(4)Cl2通入NaOH溶液中,发生反应的离子方程式:_____
(5)硫酸型酸雨产生的原因____________________________________________________
(6)SO2通入酸性高锰酸钾溶液中的离子方程式____________________________________
(7)“雷雨发庄稼”涉及的化学反应方程式_______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现用98%浓硫酸(密度1.84 g·cm3)配制浓度为0.5 mol·L1稀硫酸500mL.
(1)选用的主要仪器有:_________、________、__________、_______、
__________;
(2)请将下列操作按照正确的序号填在横线上___
A.用量筒量取浓硫酸
B.反复颠倒摇匀
C.用胶体滴管加水至刻度
D.洗净烧杯内壁和玻璃棒,并将洗液转至容量瓶
E.稀释浓硫酸
F.将溶液转入容量瓶
(3)所需浓硫酸的体积为______mL.
(4)将浓硫酸沿着烧杯内壁慢慢注入盛水的烧杯中,不断搅拌的目的是______;若搅拌过程中有液体溅出,会使最终结果______(填偏高、偏低或无影响)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分是氧化铝,含氧化铁杂质)为原料冶炼铝的工艺流程如下:
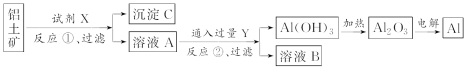
下列叙述正确的是( )
A. 反应①中试剂X是氢氧化钠溶液
B. 试剂Y是HCl,它与AlO![]() 反应生成氢氧化铝
反应生成氢氧化铝
C. 图中所示转化反应中包含2个氧化还原反应
D. 将X与Y试剂进行对换,最终可以达到相同结果
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com