
| A. | m:n之比为2:3 | B. | 18Om和16On的物质的量比为1:1 | ||
| C. | 18Om和16On的质量比为3:4 | D. | 18Om和16On的密度为2:3 |
分析 A、在同温同压同体积时,说明两者的物质的量相等,即10m:8n=5:6,由此分析解答;
B、在同温同压同体积时,说明两者的物质的量相等;
C、由A知:m:n之比为2:3,所以等物质的量18Om和16On的质量比为18m:16n=36:48=3:4;
D、根据$ρ=\frac{m}{V}$,在体积相同的情况下密度之比等于质量之比.
解答 解:A、在同温同压同体积时,说明两者的物质的量相等,即10m:8n=5:6,解之得m:n之比为2:3,故A正确;
B、在同温同压同体积时,说明两者的物质的量相等,所以18Om和16On的物质的量比为1:1,故B正确;
C、由A知:m:n之比为2:3,所以等物质的量18Om和16On的质量比为18m:16n=36:48=3:4,故C正确;
D、根据$ρ=\frac{m}{V}$,在体积相同的情况下密度之比等于质量之比,所以18Om和16On的密度为3:4,故D错误;
故选D.
点评 本题考查阿伏伽德罗定律及其推论,难度不大.掌握阿伏伽德罗定律及其推论是解题的关键.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
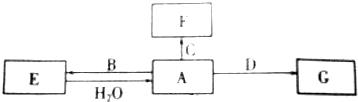
 ,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
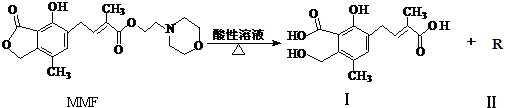
| A. | MMF分子中含有三种官能团 | |
| B. | 可以用NaHCO3溶液区别MMF与化合物Ⅰ | |
| C. | 化合物Ⅱ分子中只含碳、氢元素,属于烃类 | |
| D. | 1 mol MMF与足量NaOH 溶液共热,最多可消耗4 mol NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的金属性比镓强,铝的熔点比镓低 | |
| B. | 铝表面形成致密的氧化膜,所以可以用铝制容器来腌制咸菜 | |
| C. | Ga(OH)3与Al(OH)3性质相似,一定能与NaOH溶液反应 | |
| D. | 铝镓合金与水反应后的物质可以回收利用冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单阳离子的氧化性:A>C | |
| B. | 可用单质的活泼性来比较B、D元素的非金属性 | |
| C. | 简单离子半径:C>D>E>B | |
| D. | E元素的某化合物A2E2O8中E的化合价为+7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ① | B. | ②和③ | C. | ④ | D. | ①和④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸溶液中c(CH3COOH)大于NaOH溶液中c(Na+) | |
| B. | 乙酸溶液中水的电离程度比NaOH溶液中的小 | |
| C. | 若两溶液混合后pH=7,则有:c(Na+)═c(CH3COOH)+c(CH3COO-) | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com