
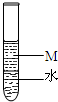
 如图所示,试管中物质M可能是( )
如图所示,试管中物质M可能是( )| A、乙醇 | B、苯 | C、溴苯 | D、四氯化碳 |
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源: 题型:阅读理解
| ||
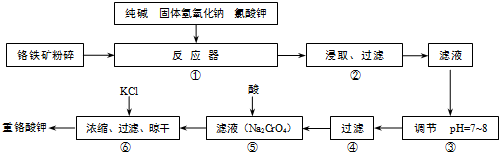
| 操作步骤 | 实验现象 | 结论 |
| ①取滤渣样少量于试管中,加足量稀HCl,搅拌,静置. | 试管中仍有固体物质 | 固体为 |
| ②操作①后,过滤;在滤液中加入过量的 |
有红褐色沉淀产生 | 沉淀为Fe(OH)3 |
| ③将操作②后的红褐色沉淀滤去,在滤液中通入足量CO2. | 生成物为Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白.要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是
(1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白.要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验步骤 | 实验现象 |
| I.向编号为①②③的3支试管中,分别加入1mL 20%的蔗糖溶液,向试管②和③中加入0.5mL稀硫酸,并将这3支试管同时水浴加热约5min | 均无明显现象 |
| II.取试管①和②,加入新制氢氧化铜悬浊液,加热至沸腾 | 均无明显现象 |
| III.取试管③,先加入NaOH溶液调溶液pH至碱性,再加入新制氢氧化铜悬浊液,加热至沸腾 | |
| 结论:证明蔗糖在稀硫酸作用下发生了水解反应 | |
| 产物 | 氢气 | 甲烷 | 乙烯 | 丙烯 | 苯 | 甲苯 | 碳 |
| 质量分数(%) | 12 | 24 | 12 | 16 | 20 | 10 | 6 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年安徽省池州市高三上学期期末统考理综化学试卷(解析版) 题型:实验题
(1)向蓝色石蕊试纸上滴加几滴饱和氯水,发现试纸先变红后变白。要确证使石蕊褪色的物质是次氯酸,还必须要做的实验是 :
a.干燥的氯气能否使试纸变白 b.水能否使试纸变白 c.盐酸能否使试纸变白
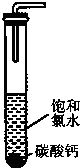
(2)饱和氯水与石灰石的反应是制取较浓HC1O溶液的方法之一。如图所示在试管中加入过量的块状碳酸钙.再加入约20ml饱和氯水充分反应,有少量气泡产生,溶液浅黄绿色褪去:过滤,将滤 液滴在蓝色石蕊试纸上发现其漂白性比饱和氯水的更强:已知饱和氨水中存在Cl2+H2O H++C1-+HClO.反应后所得的溶液漂白性增强的原因是
(用化学平衡移动原理解释)。
H++C1-+HClO.反应后所得的溶液漂白性增强的原因是
(用化学平衡移动原理解释)。

(3)碳酸钙与氯水反应生成的含钙的化合物除氯化钙外,有人提出如下猜想
a.含次氯酸钙 b.含碳酸氢钙 c.含次氯酸钙和碳酸氢钙。
有人认为不可能含有次氯酸钙.他的理由可能是 。
为了证明碳酸氢钙的存在,将滤液分为三份.分别进行以下实验:
①第一份与澄清石灰水混合,立即产生大量白色沉淀:此实验____(填“能”或“不能”)确证溶液中含有碳酸氢钙因为 ;
②第二份与稀盐酸混合,立即产生大量无色气体:
③将第三份加热,看到溶液变浑浊且有大量无色气体产生。反应的化学方程式为
④除上述实验外,你能设计的确证碳酸氢钙存在的实验方案是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com