
分析 (1)水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度;
(2)除杂时不能引入新的杂质;
(3)阳离子交换树脂可以实现阳离子之间的交换,阳离子交换树脂交换出氢离子,若使用NaR作为阳离子交换树脂失效后可放入5%~8%饱和食盐水离子交换树脂再生;
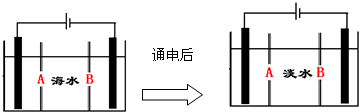
(4)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过;
②根据阳极是氯离子放电,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大.
解答 解:(1)因水的硬度是由钙和镁的硫酸盐或氯化物等引起的,这种硬度叫做永久硬度,
故答案为:永久;
(2)因除杂时不能引入新的杂质,过量的钙离子通过纯碱来除去,故先加石灰,后加纯碱
故答案为:石灰;纯碱;过量的钙离子通过纯碱来形成沉淀除去;
(3)根据阳离子交换树脂可以实现阳离子之间的交换,阳离子交换树脂交换出氢离子,若使用NaR作为阳离子交换树脂失效后可放入5%~8%饱和食盐水离子交换树脂再生,
故答案为:氢离子;饱和食盐水;
(4)①阴离子交换膜只允许阴离子自由通过,阳离子交换膜只允许阳离子自由通过,隔膜B和阴极相连,阴极是阳离子放电,所以隔膜B是阳离子交换膜,
故答案为:B;
②根据阳极是氯离子放电:2Cl--2e-═Cl2↑,阴极区是氢离子得到电子生成氢气,氢氧根离子浓度增大,和钙离子,镁离子形成沉淀,
故答案为:出现白色沉淀.
点评 本题考查物质的分离提纯,为高频考点,侧重于化学与生活的考查,注重知识的迁移应用,难度不大,能较好的考查学生分析和解决问题的能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. | 未加入稀盐酸之前:c(HCN)>c(Na+)>c( CN-)>c(OH-)>c(H+) | |
| B. | 加稀盐酸后溶液中c(CN-)+c(HCN)=c(Na+) | |
| C. | pH=7时,溶液中:c( Na+)=c( CN-) | |
| D. | 加稀盐酸后H2O的电离程度减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第七周期0族 | B. | 第八周期第ⅠA族 | C. | 第六周期第ⅡA族 | D. | 第七周期第ⅦA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋酸溶液的pH=a,将此溶液加水稀释后,溶液中各微粒浓度均减小 | |
| B. | 将浓度均为0.01 mol•L-1的CH3COOH和CH3COONa溶液等体积混合后,溶液中:c(CH3COOH)+c(CH3COO-)=0.01mol•L-1 | |
| C. | 将等体积,pH值均为3的醋酸和盐酸,分别加水稀释至amL和bmL,稀释后溶液的pH值均为5,则b>a=100 | |
| D. | 一定温度下,向0.1mol•L-1的醋酸溶液中加少量烧碱,溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
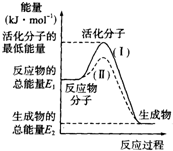 (1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.
(1)在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需要提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察下图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
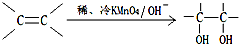 ).在下列转化关系中,P为高分子化合物.
).在下列转化关系中,P为高分子化合物.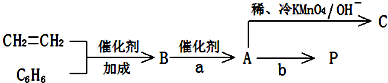
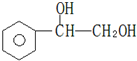 ,C与足量醋酸反应的化学方程式为
,C与足量醋酸反应的化学方程式为 ;
;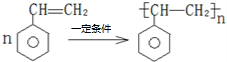 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HSO3溶于少量的NaOH溶液中:HSO3-+OH-═SO32-+H2O | |
| B. | 向NaAlO2溶液中通入过量CO2:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| C. | 硫化亚铁溶于稀硝酸中:FeS+2H+═Fe2++H2S↑ | |
| D. | 在NaHSO4溶液中滴加Ba(OH)2至中性:H++SO42-+Ba2++OH-═BaSO4↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
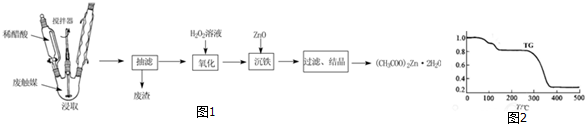
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4υ(NH3)=5υ(O2) | B. | 5υ(O2)=6υ(H2O) | C. | 2υ(NH3)=3υ(H2O) | D. | 4υ(O2)=5υ(NO) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com