
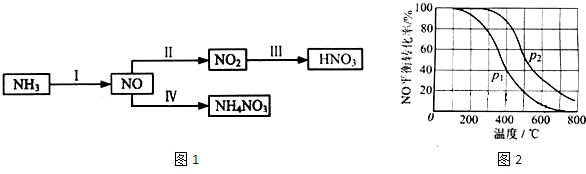
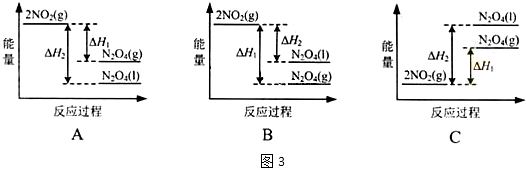
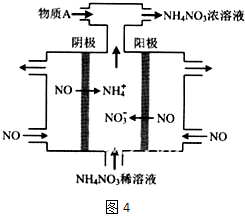
| ||
| △ |
| ||
| △ |
| ||
| ||


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
| 选项 | 待提纯的物质 | 选用的试剂 | 操作方法 |
| A | NaCl(Na2CO3) | 盐酸 | 蒸发结晶 |
| B | CO2(CO) | O2 | 点燃 |
| C | Zn (Cu) | 稀硫酸 | 过滤 |
| D | 乙醇(水) | 生石灰 | 蒸馏 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
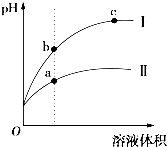 某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示.据图判断不正确的是( )
某温度下,相同pH的盐酸和醋酸溶液分别加水稀释,平衡pH随溶液体积变化的曲线如图所示.据图判断不正确的是( )| A、I是盐酸,Ⅱ是醋酸 |
| B、溶液的导电性a>b>c |
| C、a、b、c三点KW的数值相同 |
| D、稀释前等体积的 I、Ⅱ溶液中和氢氧化钠的能力相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:
Ⅰ.某实验小组对H2O2的分解做了如下探究.下表是该实验小组研究影响H2O2分解速率的因素时记录的一组数据,将质量相同但状态不同的MnO2分别加入盛有15mL 5%的H2O2溶液的大试管中,并用带火星的木条测试,结果如下:| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:
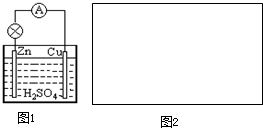 原电池是直接把化学能转化为电能的装置.
原电池是直接把化学能转化为电能的装置.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、乙烯的电子式是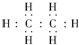 |
| B、乙烯的结构式为CH2CH2 |
C、乙烯中碳原子的结构示意图为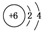 |
| D、5.6L乙烯中含有1mol C-H键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com