
【题目】煤是我国重要的化石燃料,煤化工行业中产生的H2S也是一种重要的工业资源.
(1)煤液化是_____(填“物理”或“化学”)变化过程。
(2)煤液化过程中产生的H2S可生产硫酸,部分过程如图所示:
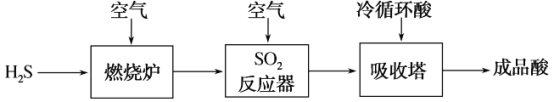
①SO2反应器中的化学方程式是_____。
②生产过程中的尾气需要测定SO2的含量符合标准才能排放.已知有V L(已换算成标准状况)尾气,通入足量H2O2吸收再加足量BaCl2溶液充分反应后(不考虑尾气中其他成分的反应),过滤、洗涤、干燥、称量得到b g沉淀。尾气中SO2的含量(体积分数)的计算式是_____。
(3)H2S还可用于回收单质硫.含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,可实现空气脱硫,得到单质硫.FeCl3溶液吸收H2S过程中,溶液中的n(Fe3+)、被吸收的n(H2S) 随时间t的变化如图。
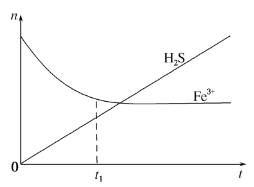
①由图中信息可知,0~t1时,一定发生的反应是_____(用离子方程式表示)。
②t1以后,溶液中n(Fe3+)保持基本不变,原因是_____。
【答案】化学 2SO2+O2![]() 2SO3
2SO3 ![]() H2S+2Fe3+=2Fe2++S↓+2H+ t1时刻后,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,所以n(Fe3+)基本不变(或2H2S+O2=2S+2H2O)
H2S+2Fe3+=2Fe2++S↓+2H+ t1时刻后,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,所以n(Fe3+)基本不变(或2H2S+O2=2S+2H2O)
【解析】
(1)煤液化就是以煤为原料生产甲醇的过程,是化学变化;
(2)煤液化过程中产生的H2S可生产硫酸的流程为:煤液化过程中产生的H2S被空气中的氧气氧化成二氧化硫,二氧化硫进一步被氧化成三氧化硫,在吸收塔中冷循环酸吸收三氧化硫生成硫酸,据此答题;
(3)含有H2S和空气的尾气按一定流速通入酸性FeCl3溶液,硫化氢被铁离子氧化成单质硫,随着时间的推移,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,生成硫,所以n(Fe3+)基本不变,硫化氢不断被氧化成硫单质,据此答题。
(1)煤的液化、气化、干馏过程都有新物质生成,都属于化学变化过程;
(2)①SO2在反应器中与空气反应使其转化为SO3,故反应器中的化学方程式2SO2+O2![]() 2SO3;
2SO3;
②利用H2O2吸的氧化性是二氧化硫转化成硫酸,即H2O2吸收SO2的化学方程式SO2+H2O2=H2SO4,设尾气中SO2的标况下的体积为x,根据

则x=![]() ,尾气中SO2的含量(体积分数)的计算式为
,尾气中SO2的含量(体积分数)的计算式为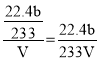 ;
;
(3)①由图中信息可知,0~t1段溶液中的n(Fe3+)逐渐减小,是因为H2S和FeCl3溶液发生了反应生成了硫单质其离子方程式为H2S+2Fe3+=2Fe2++S↓+2H+;
②H2S+2Fe3+=2Fe2++S↓+2H+;在酸性条件下,溶液中的Fe2+被O2氧化为Fe3+,Fe3+再与H2S发生氧化还原反应,所以n(Fe3+)基本不变(或2H2S+O2=2S+2H2O)。


科目:高中化学 来源: 题型:
【题目】依据粗盐提纯的原理,除去氯化钾溶液中少量的氯化镁、硫酸镁等杂质,可选用氢氧化钡溶液、稀盐酸和碳酸钾溶液三种试剂,按如图步骤操作:
![]()
(1)A的化学式是__________,B的化学式是________,C的化学式是__________。
(2)加入过量A的目的是__________________。
(3)加入过量B的目的是____________________。
(4)加热煮沸的目的是________________________。
(5)操作Ⅰ的名称是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液。然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。方案如下:
编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度℃ | ||
浓度/(mol·L-1) | 体积/mL | 浓度/(mol·L-1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4,该反应的离子方程式为______________________,每消耗1 mol H2C2O4转移_____mol电子。为了观察到紫色褪去,H2C2O4与KMnO4初始的物质的量需要满足的关系为n(H2C2O4):n(KMnO4)≥________。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=________mol·L-1·s-1。
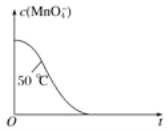
(4)已知50 ℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO4-)~t的变化曲线示意图。_____________
(5)有同学做实验时发现,酸性高锰酸钾溶液与草酸溶液反应开始时,溶液褪色慢,但过了一段时间后溶液褪色明显加快。针对上述实验现象,该同学提出以下的猜想。
猜想a:酸性高锰酸钾与草酸溶液的反应放热,导致溶液温度升高,反应速率加快。
猜想b:________________________________________。
若用实验证明你的猜想。除酸性高锰酸钾溶液,草酸溶液外,还需要选择的试剂最合理的是__________
A硫酸钾 B硫酸锰 C二氧化锰 D水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列热化学方程式:
①H2(g)+![]() O2(g)═H2O(l) △H=﹣285.8kJmol﹣1
O2(g)═H2O(l) △H=﹣285.8kJmol﹣1
②H2(g)+![]() O2(g)═H2O(g) △H=﹣241.8kJmol﹣1
O2(g)═H2O(g) △H=﹣241.8kJmol﹣1
③C(s)+![]() O2(g)═CO(g) △H=﹣110.5kJmol﹣1
O2(g)═CO(g) △H=﹣110.5kJmol﹣1
④CO2(g)═C(s)+O2(g) △H=+393.5kJmol﹣1
回答下列各问题:
(1)上述反应中属于放热反应的是___。
(2)H2的燃烧热为___;C的燃烧热为___。
(3)燃烧10gH2生成液态水,放出的热量为___。
(4)CO燃烧的热化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计一个燃料电池(如下图所示),目的是探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。
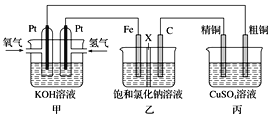
(1)通入氢气的电极为________ (填正极或负极),该电极反应式为________。
(2)石墨电极为________ (填阳极或阴极),乙中总反应化学方程式为________;如果把铁电极和石墨电极交换,乙溶液左侧出现的现象是_________。
(3)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将__________(填“增大”“减小”或“不变”)。
(4)若甲中消耗0.01mol O2,丙中精铜增重_________克。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的二氧化硫和含0.7 mol氧气的空气(忽略CO2)放入一定体积的密闭容器中,550℃时,在催化剂作用下发生反应2SO2+O2![]() 2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
2SO3。反应达到平衡后,将容器中的混合气体通过过量氢氧化钠溶液,气体体积减小了21.28 L;再将剩余气体通过一种碱性溶液吸收氧气,气体的体积又减少了5.6 L(以上气体体积均为标准状况下的体积)。(计算结果保留一位小数)请回答下列问题:
(1)判断该反应达到平衡状态的标志是(填字母)__________________。
a.二氧化硫和三氧化硫浓度相等
b.三氧化硫百分含量保持不变
c.容器中气体的压强不变
d.三氧化硫的生成速率与二氧化硫的消耗速率相等
e.容器中混合气体的密度保持不变
(2)求该反应达到平衡时,消耗二氧化硫的物质的量占原二氧化硫的物质的量的百分比____。
(3)若将平衡混合气体的5%通入过量的氯化钡溶液中,生成沉淀的质量是多少?______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.基态Cr原子有6个未成对电子
B.PH3和NH3分子中均含有孤电子对,且PH3提供孤电子对的能力强于NH3
C.BeO的晶格能大于MgO,可推测BeCO3的分解温度低于MgCO3
D.向1mol配合物![]() 中加入足量AgNO3溶液,可以得到3molAgCl沉淀
中加入足量AgNO3溶液,可以得到3molAgCl沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用空气催化氧化法除掉电石渣浆(含CaO)上清液中的![]() ,制取石膏(
,制取石膏(![]() )的过程如下:
)的过程如下:
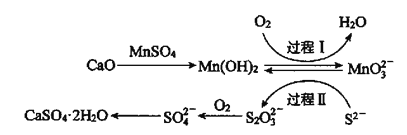
下列说法错误的是( )
A.![]() 属于盐类和纯净物
属于盐类和纯净物
B.过程Ⅱ中,反应的离子方程式为![]()
C.过程Ⅰ后溶液pH减小
D.将10L上清液中的![]() (
(![]() 浓度为
浓度为![]() )转化为
)转化为![]() ,理论上共需要0.15molO2
,理论上共需要0.15molO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种智能双模式海水电池,满足水下航行器对高功率和长续航的需求。负极为Zn,正极放电原理如图。下列说法错误的是( )
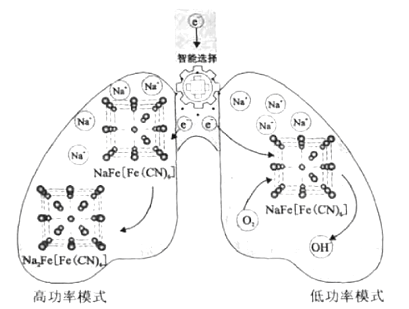
A. 电池以低功率模式工作时,NaFe[Fe(CN)6]作催化剂
B. 电池以低功率模式工作时,Na+的嵌入与脱嵌同时进行
C. 电池以高功率模式工作时,正极反应式为:NaFe[Fe(CN)6]+e-+Na+=Na2Fe[Fe(CN)6]
D. 若在无溶解氧的海水中,该电池仍能实现长续航的需求
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com