
分析 (1)Ni是28号元素,根据能量最低原则、泡利不相容原理和洪特规则,写出其核外电子排布式为:1s22s22p43s23p43d84s2,据此判断其所在位置;
(2)依据电池反应分析,充电为电解池,放电为原电池;放电过程中原电池的负极上失电子发生氧化反应,正极上发生还原反应;
(3)放电时正极发生还原反应,正极反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是该电极反应的逆反应;
(4)电解NaCl溶液,且电解池的电极均为惰性电极,阴极生成氢气,电极方程式为2H++2e-=H2↑,阳极生成氯气,电极方程式为2Cl--2e-=Cl2↑,根据电子守恒计算;
(5)①逐滴加入NaOH溶液,刚开始沉淀时需要的c(OH-)越小越先沉淀,根据溶度积常数计算;
②根据溶度积常数计算.
解答 解:(1)Ni是28号元素,其核外电子排布式为:1s22s22p43s23p43d84s2,位于元素周期表第10列,其在元素周期表位置为:第四周期第Ⅷ族;
故答案为:第四周期第Ⅷ族;
(2)根据原电池在放电时,负极发生氧化反应,正极发生还原反应,再根据元素化合价变化,可判断该电池负极发生反应的物质为Fe被氧化发生氧化反应,正极为NiO2,被还原发生还原反应,此电池为碱性电池,在书写电极反应和总电池反应方程式时不能出现H+,故放电时的电极反应是:负极:Fe-2e-+2OH-=Fe(OH)2,正极:NiO2+2e-+2H2O=Ni(OH)2+2OH-,所以该电池发生氧化反应的物质是Fe;
故答案为:A;
(3)放电时正极发生还原反应,正极反应式为:NiO2+2e-+2H2O=Ni(OH)2+2OH-,充电时该电极发生氧化反应,是该电极反应的逆反应,电极反应式为:Ni(OH)2+2OH--2e-=NiO2+2H2O,
故答案为:Ni(OH)2+2OH--2e-=NiO2+2H2O;
(4)电解NaCl溶液,且电解池的电极均为惰性电极,阴极生成氢气,电极方程式为2H++2e-=H2↑,阳极生成氯气,电极方程式为2Cl--2e-=Cl2↑,电路中转移了0.1mol e-,可知生成0.05molCl2,体积为0.05mol×22.4L/mol=1.12L,电解后c(OH-)=$\frac{0.1mol}{1L}$=0.1mol/L,则c(H+)=1×10-13,溶液的pH=13,
故答案为:1.12L;13;
(5)①逐滴加入NaOH溶液,刚开始沉淀时需要的c(OH-)越小越先沉淀,根据溶度积常数,Fe3+开始沉淀时需要的c(OH-)=$\root{3}{\frac{1×1{0}^{-38}}{0.1}}$=$\root{3}{0.1}$×10-12mol/L,Ni2+开始沉淀时需要的c(OH-)=$\sqrt{\frac{1.0×1{0}^{-15}}{0.1}}$=10-7mol/L,Fe3+开始沉淀时需要的c(OH-)比Ni2+开始沉淀时需要的c(OH-)小,则Fe3+先沉淀,
故答案为:Fe3+;
②,Fe3+沉淀完全c(Fe3+)约为10-5mol/L,则Fe3+沉淀完全c(OH-)应大于$\root{3}{\frac{1×1{0}^{-38}}{1{0}^{-5}}}$=1×10-11mol/L,c(H+)=1×10-3mol/L,溶液的pH>3,Ni2+开始沉淀时需要的c(OH-)=$\sqrt{\frac{1.0×1{0}^{-15}}{0.1}}$=10-7mol/L,c(H+)=$\frac{1×1{0}^{-14}}{1{0}^{-7}}$=10-7mol/L,Ni2+不沉淀,溶液的pH还必须小于7,则要想使Fe3+沉淀完全,Ni2+不沉淀,溶液的pH需控制的范围是3<pH<7,
故答案为:3<pH<7.
点评 本题以蓄电池为载体考查了化学电源新型电池、原电池的工作原理、溶度积常数的计算,注意把握判断该电池的正负极及电极反应式.要学会从教材中找出知识点原型进行知识迁移、解决问题的方法,题目难度中等.


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:选择题
| A. | 24 | B. | 42 | C. | 66 | D. | 108 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在AlCl3溶液中:Na+、NH4+、S2O32-、SO42- | |
| B. | 使pH试纸变蓝色的溶液中:Cu2+、NO3-、Fe3+、SO42- | |
| C. | 与铝粉反应放出氢气的无色溶液中:Na+、Al3+、SO42-、NO3- | |
| D. | 常温下$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中:K+、AlO2-、Na+、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
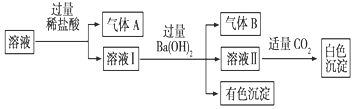 某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如图实验,下列判断正确的是( )
某水溶液中可能存在Na+、Al3+、Fe2+、NH4+、NO3-、CO32-、SO42-中的若干种离子,且存在的各离子具有相同的物质的量,某同学对该溶液进行如图实验,下列判断正确的是( )| A. | 气体A一定是CO2,气体B一定是NH3 | |
| B. | 白色沉淀一定是Al(OH)3 | |
| C. | 溶液中一定存在Fe2+、NO3-、NH4+、SO42- | |
| D. | 溶液中可能存在Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH、FeSO4在空气中放置变质 | B. | 氯水、AgI密封保存在棕色试剂瓶中 | ||
| C. | 乙烯使溴水和酸性KMnO4溶液褪色 | D. | 常温下浓硝酸不能溶解Al和Au(金) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 将碳酸氢钠分解产生的气体通入CaCl2溶液 | 产生白色沉淀 | CO2与CaCl2溶液反应 |
| B | 常温下将Al片放入浓硝酸中 | 无明显现象 | Al与浓硝酸不反应 |
| C | 将水蒸气通过灼热的铁粉 | 有黑色晶体生成 | 铁与水在高温下发生反应 |
| D | 将0.1mol•L-1MgSO4溶液滴入NaOH溶液至不在有沉淀产生,再滴加0.1mol•L-1CuSO4溶液 | 先有白色沉淀生成后变为浅色蓝色沉淀 | Mg(OH)2的溶度积(Ksp)比Cu(OH)2小 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | 容器 | 起始时物质的量 mol | 平衡时物质的量/mol | 平衡常数(K) | |
| Fe2O3 | CO | Fe | |||
| 1 | 恒温 | 0.5 | 1.5 | 0.8 | K1 |
| 2 | 恒温 | 2 | 3 | m | K2 |
| 3 | 绝热 | 1 | 1.5 | n | K3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com