
 糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.
糖尿病是由于体内胰岛素紊乱导致的代谢紊乱综合症,以高血糖为主要标志.长期摄入高热量食品和缺少运动都易导致糖尿病.

 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案科目:高中化学 来源: 题型:


 (苯胺,易被氧化)
(苯胺,易被氧化)查看答案和解析>>
科目:高中化学 来源: 题型:

| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
| ||
| ||
| 太阳光 |
| 高温 |



查看答案和解析>>
科目:高中化学 来源: 题型:
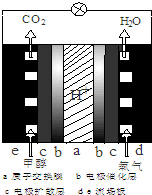 以甲醇为替代燃料是解决我国石油资源短缺的重要措施.
以甲醇为替代燃料是解决我国石油资源短缺的重要措施.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积 |
| B、晶胞中原子的配位数分别为:①6,②8,③8,④12 |
| C、金属镁采取③的堆积方式 |
| D、空间利用率的大小关系为:①<②<③<④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com