
【题目】在无色溶液中,下列离子能大量共存的是( )
A.Mg2+、SO42-、K+、Cl-B.Na+、NH4+、NO3-、MnO4-
C.K+、Cu2+、Cl-、Br-D.Ba2+、Na+、OH-、CO32-
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A. 1 mol氯气参加氧化还原反应,转移的电子数一定为2NA
B. 标准状况下,以任意比混合的氢气和一氧化碳气体共8.96 L,在足量氧气中充分燃烧时消耗氧气的分子数为0.2NA
C. 含1 mol FeCl3的溶液中Fe3+的个数为NA
D. 1.8 g NH4+中含有的电子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是( )
A. 共价化合物中没有离子键
B. 离子化合物中不一定没有共价键
C. 共价化合物中可以有离子键
D. 离子键只能存在于离子化合物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向25 mL 0.1 mol.L-1NaOH溶液中逐滴滴加0.2 mol.L-1的HN3(叠氮酸)溶液,pH的变化曲线如图所示(溶液混合时体积的变化忽略不计,叠氮酸的Ka=10-4.7)。下列说法正确的是
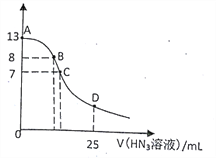
A. 水电离出的c(H+):A点小于B点
B. 在B点,离子浓度大小为c(OH-)>c(H+)>c (Na+)>c(N3-)
C. 在C点,滴加的V(HN3)=12.5 mL
D. 在D点,c(Na+)=2c(HN3)+2 c(N3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有一定条件下进行的反应:Cu+2H2O=Cu(OH)2+H2↑,有人想根据该反应设计原电池,下列说法正确的是
A. 可以铜为负极,碳为正极,氯化钠为电解质溶液构成原电池
B. 可以铜为正极,碳为负极,氯化钠为电解质溶液构成原电池
C. 可以铜为负极,碳为正极,稀硫酸为电解质构成原电池
D. 该反应不能构成原电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NO2和Br2蒸汽都是红棕色、有刺激性气味的气体。下列不能用来区别这两种气体的试剂是( )
A. CCl4 B. 蒸馏水 C. 浓硫酸 D. AgNO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据化学反应的实质是旧键断裂和新键形成这一事实,下列变化不属于化学变化的是( )
A. 钠投入水中 B. 石墨在高温高压下转化为金刚石
C. 干冰汽化 D. 五氧化二磷吸水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种很好的燃料,工业上一般在恒容密闭容器中可以采用下列反应合成甲醇:
CO(g)+2H2(g)![]() CH3OH(g) ΔH
CH3OH(g) ΔH
(1)判断反应达到平衡状态的依据是(填字母序号, 下同)__________。
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.CH3OH、CO、H2的浓度都不再变化
(2)下表所列数据是反应在不同温度下的化学平衡常数(K)。
温度 | 250 °C | 300 °C | 350 °C |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断ΔH__________0(填”>”“< “或”=“);
②某温度下,将2 mol CO和6 mol H2充入2 L 的密闭容器中,充分反应后,达到平衡时测得c(CO)=
0.2 mol L1,则CO的转化率为_______,此时的温度为______________。
(3)要提高CO的转化率,可以采取的措施是_______。
a.升温 b.加入催化剂
c.增加CO的浓度 d.加入H2加压
e.加入惰性气体加压 f.分离出甲醇
(4)300 °C,一定的压强下,5mol CO与足量H2在催化剂的作用下恰好完全反应变化的热量为454kJ。在该温度时,在容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:
容器 | 甲 | 乙 | 丙 | |
反应物投入量 | 1 mol CO、 2 mol H2 | 1 mol CH3OH | 2 mol CH3OH | |
平衡时数据 | CH3OH的浓度 / (mol L1) | c1 | c2 | c3 |
反应的能量变化 | a kJ | b kJ | c kJ | |
体系压强/ Pa | p1 | p2 | p3 | |
反应物的转化率 | α1 | α2 | α3 | |
下列说法正确的是_________。
A.2 c1>c3 B.a+b<90.8
C.2p2 <p3 D.α1 +α3<l
(5)为了寻找合成甲醇的温度和压强的适宜条件, 某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
实验编号 | T/℃ | n(CO)/n(H2) | p/MPa |
1 | 150 | 1/3 | 0.1 |
2 | a | 1/3 | 5 |
3 | 350 | b | 5 |
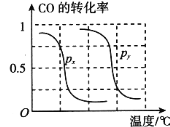
①则上表中剩余的验条件数据a=_________,b=_________。
②根据反应的特点,上图是在压强分别为0.1 MPa和5 MPa下CO的转化率随温度变化的曲线图,请指明图中的压强px=_________MPa。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫元素形成的化合物有着广泛的用途。 请回答下列问题:
(1) 过二硫酸及其盐在工业上常用作强氧化剂。
①过二硫酸的结构为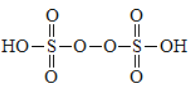 ,其中氧元素的化合价为________。
,其中氧元素的化合价为________。
②过二硫酸铵溶液可用于检验溶液中的 Mn2+,现象为溶液变为紫红色。该反应的离子方程式为______。
③电解法是制备过二硫酸钾的方法之一, 其装置示意图如下:
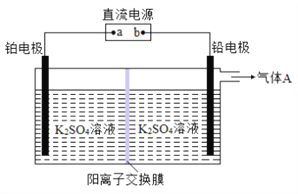
则:b 为电源的______极; 阳极反应式为_________________; 导线中流过 1 mol 电子时, 理论上通过阳离子交换膜的K+的数目为___________。
(2)Na2SO4是重要的工业原料,检验其溶液中含有SO42-的操作及现象为______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com