
在水中加等物质的量的Ag+、Pb2+、Na+、SO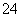 、NO
、NO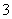 、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
、Cl-,该溶液放在用惰性电极作电极的电解槽中,通电片刻,则氧化产物与还原产物质量比为( )
A.35.5∶108 B.16∶207 C.8∶1 D.108∶35.5
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列关于热化学反应的描述中正确的是( )
A.HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1。则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+2×283.0 kJ·mol-1
C.C2H6的燃烧热为Q kJ·mol-1,则表示C2H6燃烧热的热化学方程式为2C2H6(g)+7O2(g)====4CO2(g)+6H2O(l) ΔH=-2Q kJ·mol-1
D.1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.书写热化学方程式时,只要在化学方程式的右端写上热量的符号和数值即可
B.凡是在加热或点燃条件下进行的反应都是吸热反应
C.表明反应所放出或吸收热量的化学方程式叫做热化学方程式
D.氢气在氧气中燃烧的热化学方程式是
2H2(g)+O2(g)===2H2O(l) ΔH=-483.6 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
2H2O(l)===2H2(g)+O2(g) ΔH=571.6 kJ·mol-1
2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1
当1 g液态水变为气态水时,对其热量变化的下列描述:①放热;②吸热;③2.44 kJ;
④4.88 kJ;⑤88 kJ。其中正确的是( )
A.②和⑤ B.①和③ C.②和④ D.②和③
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
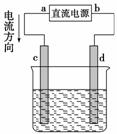
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
在50 mL 0.2 mol·L-1 CuSO4溶液中插入两个电极,通电电解(不考虑水分蒸发)。则:
(1)若两极均为铜片,试说明电解过程中CuSO4溶液的浓度________(填“增大”、“减小”或“不变”)。
(2)若阳极为纯锌,阴极为铜片,阳极反应式是________________________________________________________________________
________________________________________________________________________。
(3)若阳极为纯锌,阴极为铜片,如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重________g,阴极上的电极反应式是________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是( )
A.原子最外层电子数为2的元素一定处于周期表ⅡA族
B.元素周期表中从ⅢB族到ⅡB族10个纵行的元素都是金属元素
C.硫化氢的沸点比水的沸点高
D.同主族元素形成的氧化物的晶体类型均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
“轻轨电车”是近年新兴的一种交通工具。当电车开动时,在电车与架空电线的接触点上,由于高速摩擦会产生高温,因此接触点上的材料应该是具有耐高温,能导电的性质,你认为该接触点上材料的选用较为合适的是( )
A.金刚石 B.铝
C.石墨 D.铜
查看答案和解析>>
科目:高中化学 来源: 题型:
某温度时,把1 mol N2O4气体通入体积为10 L的真空密闭容器中,立即出现红棕色,反应进行4 s时NO2的浓度为0.04 mol·L-1,再经过一定时间后,反应达到平衡,这时容器内压强为开始时的1.8倍。则下列说法正确的是( )
A.前4 s以N2O4的浓度变化表示的平均反应速率为0.01 mol·L-1·s-1
B.4 s时容器内的压强为开始时的1.2倍
C.平衡时容器内含0.4 mol N2O4
D.平衡时容器内含0.8 mol NO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com