
| A. | 钠原子与氯原子反应生成NaCl后,其结构的稳定性增强 | |
| B. | 阴、阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距离相当小 | |
| C. | 失电子难的原子获得电子的能力一定强 | |
| D. | 任何离子键在形成的过程中必定有电子的得与失 |
分析 A.钠原子和氯原子通过得失电子都达到稳定结构;
B.离子化合物中离子键存在静电作用;
C.根据原子得失电子的难易与其最外层电子的关系分析;
D.离子键的形成过程中不一定有电子得失.
解答 解:A.钠原子和氯原子通过得失电子都达到稳定结构,所以钠原子和氯原子作用生成NaCl后,其结构的稳定性增强,故A正确;
B.离子化合物中离子键存在静电作用,静电作用包含吸引力和排斥力,故B错误;
C.失电子难的原子获得电子的能力不一定强,如稀有气体的原子,故C错误;
D.离子键的形成过程中不一定有电子得失,如复分解反应中离子键的形成,故D错误.
故选A.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意常见物质中的化学键,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 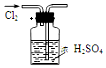 干燥Cl2 | B. |  吸收HCl | ||
| C. |  用自来水制蒸馏水 | D. |  吸收NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用pH试纸能测得氯水的pH=4 | |
| B. | 胶体区别于其他分散系的本质特征是分散质的微粒直径在1-100nm之间 | |
| C. | 所有的金属都是固态的 | |
| D. | 用平行光线照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Pt是正极 | B. | 负极反应:Zn-2e-═Zn2+ | ||
| C. | 正极反应:2H++2e-═H2↑ | D. | 正极反应:2H2O+O2+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应Ⅰ:恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应Ⅱ:绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可使用溴水鉴别植物油和汽油 | |
| B. | 利用二氧化碳制造全降解塑料,可以消除温室效应 | |
| C. | “玉兔号”月球车上的太阳能电池的材料是硅 | |
| D. | 实验室金属钠失火时,可使用泡沫灭火器灭火 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com