
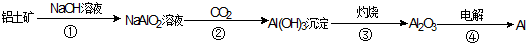
分析 氢氧化钠溶液用于分离Al2O3和其它氧化物,Al2O3溶于氢氧化钠溶液得到NaAlO2溶液,向偏铝酸钠溶液中通入过量CO2,向NaAlO2溶液中通入过量CO2的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3,生成Al(OH)3,灼烧Al(OH)3得Al2O3,电解熔融Al2O3得到Al,以此解答该题.
解答 解:(1)反应中只有④由Al2O3生成Al,元素化合价发生变化,属于氧化还原反应,其它反应不是,氢氧化铝生成氧化铝的反应为分解反应,
故答案为:④;③;
(2)铝土矿中含有氧化铝,还含有氧化铁等杂质,①加入氢氧化钠溶液得到NaAlO2溶液,②向偏铝酸钠溶液中通入过量CO2,得到氢氧化铝,③分解氢氧化铝得到纯净的氧化铝,则①②③目的为提纯氧化铝,故答案为:①②③;
(3)①为氧化铝与氢氧化钠的反应,方程式为Al2O3+2NaOH=2NaAlO2+H2O,第④步为氧化铝的电解,方程式为2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑.
点评 本题考查混合物分离提纯方法的选择和应用,为高频考点,把握混合物分离流程及发生的反应为解答的关键,侧重物质性质及分离方法的考查,明确物质性质差异性即可提纯分离物质,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式:H:Cl | |
| B. | S2-离子的电子层结构: | |
| C. | 质量数为18的氧元素的核素:${\;}_{8}^{18}$O | |
| D. | CO2的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用、制备有毒气体应在通风橱中进行,应有尾气吸收处理装置 | |
| B. | 用湿润的红色石蕊试纸检验氨气 | |
| C. | 在50 mL量筒中配制0.100 0 mol•L-1碳酸钠溶液 | |
| D. | 汞洒落后,应立即撒上硫粉,并打开墙下面的排气扇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2和SiO2 | B. | NaOH和NaCl | C. | NH4Cl 和HCl | D. | H2O2和C3H6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
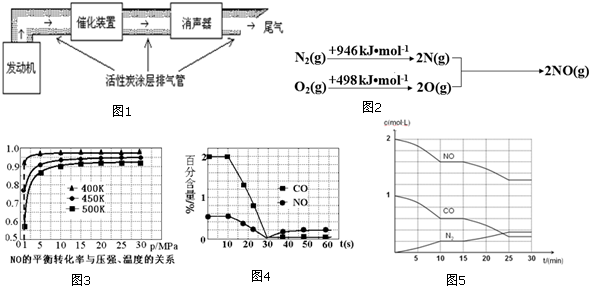
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 铬元素及其化合物在生产、生活中具有广泛的用途.
铬元素及其化合物在生产、生活中具有广泛的用途.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
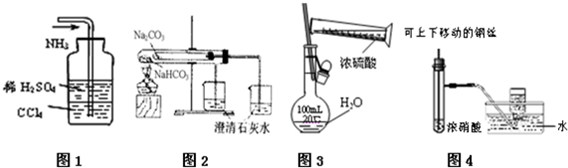
| A. | 图1吸收多余的NH3 | |
| B. | 图2为比较NaHCO3、Na2CO3相对热稳定性 | |
| C. | 图3为配制一定物质的量浓度的硫酸溶液 | |
| D. | 图4为制备并收集少量NO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为: CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 500℃、30MPa下,将0.5mol N2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| C. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热 △H=2×(-57.3)kJ•mol-1 | |
| D. | 在101 kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6 kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com