
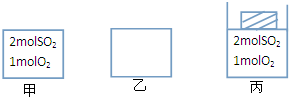
 ��ͼ��ʾ���ס��Ҿ�Ϊ�ݻ�1L�ĺ�����������Ϊ��ѹ������
��ͼ��ʾ���ס��Ҿ�Ϊ�ݻ�1L�ĺ�����������Ϊ��ѹ������
| ||
| �� |
| 2x |
| 3-x |
| ||
| 10min |
| C 2(SO 3) |
| C 2(SO 2)C(O 2) |
| 2x |
| 2 |
| C 2(SO 3) |
| C 2(SO 2)C(O 2) |
| ||
| �� |
| y |
| 2 |
| y |
| 2 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����Ҵ����͡��Ĺ㷺ʹ������Ч�����к�������ŷ� |
| B��������Һ�л������뱥�ͣ�NH4��2SO4��Һ�г����������������仯 |
| C���������䡱ȡ�����������䡱���Գ��������˱������� |
| D�����Ͳ�������ȡ������������ʯ�����Ƶõ��IJ��Ͷ������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����⾫������ʱ�������ʵĴֽ��������������Դ�������� |
| B�������н��������е����ɵ�Դ�ĸ���������ص��������ӵ��ص����������Դ������ |
| C���ڵ����У��������Һ�е��������������ƶ����������������ƶ� |
| D���ڵ�⾫�����������У��������Һ�ijɷֲ������κα仯 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��4��l0-3 mol/L |
| B��2��l0-3 mol/L |
| C��1��l0-3 mol/L |
| D��1��l0-7 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| Ԫ�ش��� | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��1��2 | B��2��5 |
| C��3��7 | D����ȷ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����ȳʺ�ɫ����Һ�У�MnO4-��Al3+��C2H5OH��SO42- | ||
B�������µ���Һ��
| ||
| C��O.1 mol/L AgNO3��Һ��H+��K+��SO42-��I- | ||
| D�����뱽������ɫ����Һ��K+��NH4+��Cl-��I- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com