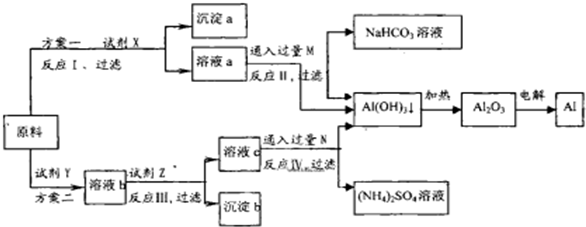
解:(1)因配制溶液的体积为480ml,而容量瓶的规格没有480ml,只能选用500ml,Na
2CO
3的物质的量n=cV=0.5L×0.1mol?L
-1=0.05mol,Na
2CO
3?10H
2O的物质的量等于Na
2CO
3的物质的量,所以Na
2CO
3?10H
2O的质量0.05mol×286g/mol=14.3g,故答案为:14.3;
(2)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,一但物体和砝码位置反了,读数时用到了游码,则称得的实际质量减小,故答案为:B;
(3)天平使用前要做到调整零点,横梁平衡,称碳酸钠晶体的质量先称空烧杯质量,记录称量结果,再测烧杯和碳酸钠晶体的总质量,记录称量结果,两次测得的质量差,就是碳酸钠晶体的质量,最后将将砝码放回砝码盒内,故答案为:D;C;
(4)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、500mL容量瓶、胶头滴管,
故答案为:500mL容量瓶;胶头滴管;
(5)A、加水定容时越过刻度线,溶液的体积偏大,浓度偏小,故选:B;
B、忘记将洗涤液转入容量瓶,溶质的质量偏小,浓度偏小,故选:B;
C、容量瓶内壁附有水珠而未干燥处理,溶液的体积不变,浓度不变,故选:C;
D、溶解后没有冷却便进行定容,一旦冷却下来,溶液的体积偏小,浓度偏大,故选:A;
E、称量的碳酸钠晶体部分失水,溶质的质量偏大,浓度偏大,故选:A;
(6)标签上的内容为:Na
2CO
3溶液,0.1mol/L,故答案为:Na
2CO
3溶液;0.1.
分析:(1)根据n=cv计算溶质Na
2CO
3的物质的量,利用Na
2CO
3?10H
2O的物质的量等于Na
2CO
3的物质的量,根据m=nM计算Na
2CO
3?10H
2O的质量;
(2)根据天平的称量原理;
(3)根据天平称取一定质量固体的方法;
(4)根据实验操作的步骤以及每步操作需要仪器确定反应所需仪器;
(5)根据c=

分析操作对溶质的物质的量或对溶液的体积的影响判断;
(6)标签上的内容应注明物质的名称和浓度.
点评:本题考查了一定物质的量浓度溶液的配制过程以及误差分析,难度不大,注意实验的基本操作方法和注意事项.

 实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题
实验室配制480mL0.1mol/LNa2CO3溶液回答下列问题 分析操作对溶质的物质的量或对溶液的体积的影响判断;
分析操作对溶质的物质的量或对溶液的体积的影响判断;

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案