
【题目】下列叙述正确的是
A. 0.1 mol·L-1氨水中,c(OH-)=c(NH4+)
B. 10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C. 在0.1 mol·L-1的(NH4)2SO4溶液中,c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D. 0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的为( )
A. 铜片插入硝酸银溶液中:Cu+Ag+= Cu2++Ag
B. 稀盐酸滴在石灰石上:CaCO3+H+ = Ca2++H2CO3
C. 氢氧化钡与稀硫酸反应:Ba2++OH-+H+ +SO42-=BaSO4↓+H2O
D. 氧化镁与盐酸反应 MgO+2H+=Mg2++H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子层结构;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子。回答下列问题:
(1)四种元素中电负性最大的是_______________。(填元素符号),其中C原子的核外电子排布式为__________________________。
(2)单质A有两种同素异形体,其中沸点高的是___________(填分子式),原因是___________________。A 和B的氧化物所属的晶体类型分别为__________和___________。
(3)C和D反应可生成组成比为1∶3的化合物E,E的立体构型为______________,中心原子的杂化轨道类型为______________________。
(4)化合物D2A的立体构型为_____________,中心原子的价层电子对数为_______________,单质D与湿润的Na2CO3反应可制备D2A,其化学方程式为____________________________________。
(5)A 和B能够形成化合物F,其晶胞结构如图所示,F的化学式为_____________;晶胞中A原子的配位数为____________________。
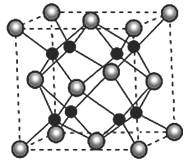
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(分子式为C13H18O2)是一种香料,如图是该香料的一种合成路线。

已知:
①E能发生银镜反应,在一定条件下,1 mol E能与2 mol H2反应生成F;
②R—CH===CH2![]() R—CH2CH2OH;
R—CH2CH2OH;
③有机物D的摩尔质量为88 g·mol-1,其核磁共振氢谱有3组峰;
④有机物F是苯甲醇的同系物,苯环上只有一个无支链的侧链。
回答下列问题:
(1)用系统命名法命名有机物B________________;
(2)E的结构简式为__________________________;
(3)C与新制Cu(OH)2反应的化学方程式为____________________________;
(4)已知有机物甲符合下列条件:①为芳香族化合物;②与F互为同分异构体;③能被催化氧化成醛。符合上述条件的有机物甲有________种,写出一种满足苯环上有3个侧链,且核磁共振氢谱有5组峰,峰面积比为6∶2∶2∶1∶1的有机物的结构简式____________________;
(5)以丙烯等为原料合成D的路线如下:

X的结构简式为_______,步骤Ⅱ的反应条件为___________,步骤Ⅳ的反应类型为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在t℃时,某NaOH稀溶液中,c(H+)=10-a mol/L,c(OH-)=10-b mol/L,已知a+b=12,则:
(1)该温度下水的离子积常数KW=________。
(2)该NaOH溶液的物质的量浓度的精确值是________mol/L。
(3)在该温度下,将100 mL 0.1 mol/L的稀硫酸与100 mL 0.4 mol/L的NaOH溶液混合后,溶液的pH=________。
Ⅱ、现有浓度均为0.1 mol/L的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵、⑤醋酸铵、⑥硫酸铵、⑦硫酸氢铵、⑧氨水,请回答下列问题:
(4)①、②、③、④四种溶液中由水电离出的H+浓度由大到小的顺序是 (填序号)___________。
(5)④、⑤、⑦、⑧四种溶液中NH![]() 浓度由大到小的顺序是 (填序号)_________________。
浓度由大到小的顺序是 (填序号)_________________。
(6)将③和④等体积混合后,混合液中各离子浓度关系正确的是________(填字母序号)。
A.c(Na+)=c(Cl-)>c(OH-)>c(NH![]() )
)
B.c(Na+)=0.1 mol/L
C.c(Na+)+c(NH![]() )=c(Cl-)+c(OH-)
)=c(Cl-)+c(OH-)
D.c(H+)>c(OH-)
Ⅲ、常温下,amol/L氯化铵溶液中加入等体积bmol/L氢氧化钠溶液,反应后混合液呈中性,求该温度下NH3·H2O的电离常数________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、氮等元素及其化合物和人类生产、生活密切相关,请回答下列问题:
(1)氨催化氧化是硝酸工业的基础,生产过程中会发生以下反应:
主反应:![]()
副反应:![]()
①工业上往往采用物料比![]() 在1.7—2.0之间,主要目的是____________。
在1.7—2.0之间,主要目的是____________。
②下表所示是部分化学键的键能参数:
化学键 | N-N | O=O |
键能/kJ· mol-1 | 946 | 497.3 |
则拆开1mol NO中的化学键需要吸收的能量是__________kJ。
(2)在一定温度下,向1L密闭恒容容器中充入l mol NO和一定物质的量的CO,在催化剂作用下发生反应:2NO (g)+2CO (g)![]() 2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
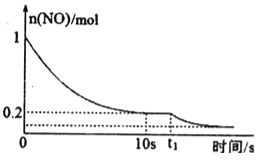
①前10 s内N2的平均生成速率为____。
②已知在t1时刻反应速率加快,则在t1时刻改变的条件可能是____。(填写一种)
(3)在723K时,将0.1mol H2和0.2mol CO2通入抽空的上述密闭容器中,发生如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
①CO2 的平衡转化率等于______,反应平衡常数K等于______(保留两位有效数字)。
②再向容器中加入过量的CoO (s)和Co (s),则容器中又会增加如下平衡:CoO (s) +H2 (g)![]() Co (s) +H2O(l)K1;CoO (s) +CO (g)
Co (s) +H2O(l)K1;CoO (s) +CO (g)![]() Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____。
Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.05 mol液态KHSO4中含有0.1NA个阳离子
B. 1 L 0.1 mol·L-1的氨水中有0.1NA个NH![]()
C. 标准状况下,22.4 L盐酸含有NA个HCl分子
D. 23gNa与O2在一定条件下反应生成Na2O和Na2O2的混合物,共转移NA个电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com