
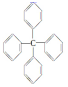
 对该分子的描述,不正确的是( )
对该分子的描述,不正确的是( )| A. | 化学式为C25H20 | B. | 所有碳原子都在同一平面上 | ||
| C. | 此分子中有极性键和非极性键 | D. | 此物质属芳香烃类物质 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
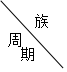 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | I | ||||
| 3 | B | C | F | H |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示装置可构成原电池.试回答下列问题:
如图所示装置可构成原电池.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工厂排放 CO2会导致酸雨的形成 | |
| B. | 使用含有氯化钙的融雪剂会加速桥梁的腐蚀 | |
| C. | “山东疫苗案”涉及疫苗未冷藏储运而失效,这与蛋白质变性有关 | |
| D. | 《黄白第十六》中有“曾青涂铁,铁赤如铜”,这与化学变化有关 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 操作 | |
| A | 配制0.1mol•L-1氯化铝溶液 | 先将氯化铝晶体溶于浓盐酸中,后加蒸馏水稀释至指定体积 |
| B | 在加热条先下氢气还原氧化铜 | 反应完成后,先停止通入氢气,后停止加热 |
| C | 浓盐酸与碳酸钙反应制备CO2 | 气体产物先通过浓硫酸,后通过饱和碳酸氢钠溶液 |
| D | 检验某溶液是否含SO42- | 先加入BaCl2溶液,后加入盐酸 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| T/K | T1 | T2 | T3 |
| K | 1.00×107 | 2.54×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com