
| B | ||
| A | X | C |
| D |
分析 A、B、C、D四种元素在周期表中分别处于元素X的四周,X元素最高价氧化物的化学式为X2O5,则X处于VA族,且五种元素中有一种元素的原子半径是它所处的同族中最小的,由元素位置可知,B为N元素、A为Si、X为P、C为S、D为As.
解答 解:A、B、C、D四种元素在周期表中分别处于元素X的四周,X元素最高价氧化物的化学式为X2O5,则X处于VA族,且五种元素中有一种元素的原子半径是它所处的同族中最小的,由元素位置可知,B为N元素、A为Si、X为P、C为S、D为As.
(1)A为硅,B为氮,C为硫,D为砷,故答案为:硅;氮;硫;砷;
(2)由于非金属性S>P>As,故最高价氧化物对应水化物酸性由强到弱的顺序:H2SO4>H3PO4>H3ASO4,
故答案为:H2SO4>H3PO4>H3ASO4;
(3)非金属性N>P>Si,故气态氢化物稳定性由强到弱的顺序:NH3>PH3>SiH4,
故答案为:NH3>PH3>SiH4;
(4)A.As的单质在通常状况下是固体,故A正确;
B.As的非金属性比P弱,难以与H2化合生成氢化物,故B正确;
C.As气态氢化物为PH3,故C错误,
故选:C.
点评 本题考查元素周期表与元素周期律应用,熟练掌握元素周期律表的结构,注意对基础知识的理解掌握.


 导学全程练创优训练系列答案
导学全程练创优训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 纯净物是指由同种元素组成的物质 | B. | 由同种元素组成的纯净物叫单质 | ||
| C. | 由不同种分子组成的物质叫化合物 | D. | 一种元素只能组成一种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
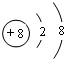 .
.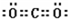 .
.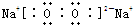 ,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程:
,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程: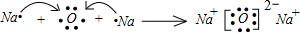 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
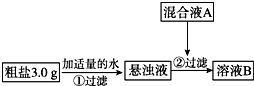 目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.
目前国内外使用的融雪剂一般有两大类:一类是以醋酸钾为主要成分的有机融雪剂;另一类是以“氯盐”为主要成分的无机融雪剂,如氯化钠、氯化钙、氯化镁等,通称“化冰盐”.某研究性学习小组拟对融雪氯盐(如图称为粗盐)(主要含有氯化钠及不溶性杂质、Mg2+、Ca2+等)进行回收提纯研究.| 化学式 | CaCO3 | CaSO3 | CaC2O4 | Mg(OH)2 |
| Ksp | 2.8×10-9 | 6.8×10-8 | 4.0×10-9 | 1.8×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| B. | CH2=CH2+Br2→BrCH2CH2Br | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{酸}$CH3CH=CH+NaCl+H2O | |
| D. | 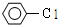 +H2O$→_{△}^{酸}$ +H2O$→_{△}^{酸}$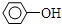 +HCl +HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com