
| A. | 长度 | B. | 气体摩尔体积 | C. | 摩尔 | D. | 摩尔质量 |
分析 国际单位制中的七个基本物理量及其单位为:长度 米(m);质量 千克(kg);时间 秒(s);电流 安培(A);热力学温度 开尔文(K);发光强度 坎德拉(cd);物质的量 摩尔(mol).据此即可解答.
解答 解:A.长度是国际单位制中的七个基本物理量之一,表示物体或线段长短的程度,故A正确;
B.气体摩尔体积是物理量,表示单位物质的量的物质所占体积,故B正确;
C.物质的量的单位是摩尔,摩尔是其单位,不属于国际单位制中的七个基本物理量之一,故C错误;
D.摩尔质量是基本物理量之一,表示单位物质的量的物质具有的质量,故D正确;
故选C.
点评 本题考查了基本物理量的掌握情况,注意物质的量是国际单位制中的七个基本物理量之一,摩尔是其单位,比较简单.


科目:高中化学 来源: 题型:解答题
| 反应阶段 | 溶液中的存在的金属离子 | 残留的金属粉末 | 发生的离子反应 |
| 第一阶段 | 只有一种 | 有两种 | (1) |
| 第二阶段 | 只有一种 | 只有一种 | |
| 第三阶段 | 只有两种 | (2) | (3) |
| 笫四阶段 | 有三种 | (4) | |
| 笫五阶段 | (5) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气体的摩尔体积为22.4 L•mol-12 | |
| B. | 1 mol H2的质量是2 g,它所占的体积是22.4 L | |
| C. | 在标准状况下,1 mol任何气体所占的体积都为22.4 L•mol-1 | |
| D. | 在标准状况下,1 mol任何气体所占的体积都约为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ②③⑤ | C. | ①②③⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
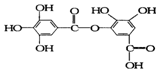
| A. | 它能与纯碱溶液反应 | |
| B. | 它可以水解,水解生成的有机产物有二种 | |
| C. | 1 mol该有机物最多能和8 mol NaOH反应 | |
| D. | 该有机物能发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 沉淀溶解后,将会生成深蓝色的配合离子[Cu(NH3)4]2+ | |
| B. | 反应后溶液中不存在任何沉淀,所以反应前后Cu2+的浓度不变 | |
| C. | 向反应后的溶液加入乙醇,溶液不会有变化,因为[Cu(NH3)4]2+不会与乙醇发生反应 | |
| D. | 在[Cu(NH3)4]2+离子中,Cu2+给出孤对电子,NH3提供空轨道 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ•mol-1) | 436 | 343 | 745 | 465 | 413 |
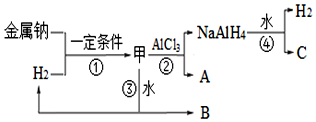
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com