
���� ��1������100mL��Һ��Ҫѡ�ù��Ϊ100mL������ƿ�������ʱ��Ҫ�ý�ͷ�ιܣ�
��2������������������Һǡ�÷�Ӧʱ���ɴ����ƣ���Һ�ʼ��ԣ����÷�̪��ָʾ����
��4���ζ�����ǰ��ҺΪ��ɫ���ζ�����ʱ��Һ��Ϊdz��ɫ���ݴ��жϵζ��յ㣻���Ӷ����������ı�Һ���ƫ�ⶨ���ƫ��
��� �⣨1����ȡ10.00mLʳ�ð״ף����ձ�����ˮϡ�ͺ�ת�Ƶ�100mL����ƿ�У�Ȼ���ý�ͷ�ιܶ��ݣ�ҡ�ȼ��ô���״���Һ��
�ʴ�Ϊ������ƿ����ͷ�ιܣ�
��2�����ڴ�������Һ��ʾ���ԣ����÷�̪��ָʾ����������ʽ�ζ���ȡ����״���Һ20.00mL����ƿ�У������еμ�2�η�̪��
�ʴ�Ϊ����̪��
��4����̪��������ʾ��ɫ����������Һ����ʾdz��ɫ����ζ��յ�ʱ��Һ����ɫ��Ϊdz��ɫ�����Եζ��յ������Ϊ����Һ����ɫ��Ϊdz��ɫ�����ڰ�����ڲ���ɫ��
����ʱ��ȡ����ʱ���ӣ����¶����ı�Һ���ƫ�ⶨ���ƫ��
�ʴ�Ϊ����Һ����ɫ��Ϊdz��ɫ�����ڰ�����ڲ���ɫ��ƫ��
���� ���⿼�����к͵ζ�����Һ���ƣ���Ŀ�ѶȲ�����ȷ�к͵ζ�����������������Һ����Ϊ���ؼ���ע������ѡ��ָʾ�����жϵζ��յ�ķ���������������ѧ���Ļ�ѧʵ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 42g������ͱ�ϩ�Ļ����������ԭ����Ŀһ��Ϊ6NA | |
| B�� | 1L 0.1mol/L��NH4NO3��Һ��ԭ��������0.2NA | |
| C�� | �ڳ��³�ѹ�£�22.4LHF����������ΪNA | |
| D�� | 5.6gFe��������ˮ������ȫ��Ӧ��ת�Ƶ��ӵ���ĿΪ0.2NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| �¶ȣ��棩 | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| V��M����x10-3mol��L-1��min-1�� | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | һ���¶��£�����ˮϡ�ͣ�NH3?H2O �ĵ��������H2O �ĵ����Ҳ���� | |
| B�� | ˮ�м���Ӽ���谭ˮ�ĵ��룬���� c��H+��?c��OH-����10-14 | |
| C�� | ˮ�м��ᣬ�谭ˮ�ĵ��룬���� c��H+��=c��OH-����10-7 mol•L-1 | |
| D�� | ������Һ��ˮϡ�ͣ���Һ����������Ũ�ȶ��ή�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 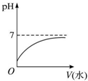 | |
| B�� | ��Һ��$\frac{c��C{H}_{3}CO{O}^{-}��}{c��C{H}_{3}COOH��•c��O{H}^{-}��}$���� | |
| C�� | ��Һ�е������ӵ���Ŀ���� | |
| D�� | �ټ���10 mL pH=11��NaOH��Һ��ǡ����ȫ�к� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | H2+Cl2�T2HCl | B�� | CuO+2H+�TCu2++H2O | ||
| C�� | H2O+CaO�TCa��OH��2 | D�� | NaOH+HCl�TH2O+NaCl |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com