
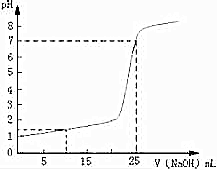
 常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:
常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸溶液中,反应过程中溶液pH和所加NaOH溶液的体积关系如图所示:分析 (1)由图可知,在加入NaOH之前,pH=1,根据c(H+)计算硫酸的浓度;
(2)当加到25mL的NaOH时pH=7,氢氧化钠与硫酸恰好完全中和,根据n(H+)=n(OH-)计算;
(3)加入10mLNaOH后,总体积V=10+20=30mL,中和掉H+为0.08×0.01=0.0008mol,剩余的H+为0.1×0.02-0.008=0.0012moL,然后计算氢离子浓度和pH.
解答 解:(1)由图可知,在加入NaOH之前,硫酸溶液的pH=1,则c(H+)=0.1mol/L,所以硫酸的浓度为c(H2SO4)=$\frac{1}{2}$c(H+)=0.05mol/L;
答:硫酸的物质的量浓度为0.05mol/L;
(2)当加到25mL的NaOH时pH=7,氢氧化钠与硫酸恰好完全中和,而由(1)可知,c(H+)=0.1mol/L,所以n(H+)=c(H+)×V(H2SO4)=n(OH-)=c(NaOH)×V(NaOH),
所以c(NaOH)=$\frac{0.1mol/L×0.02L}{0.025L}$=0.08mol/L;
答:NaOH溶液的物质的量浓度为0.08mol/L;
(3)加入10mLNaOH后,总体积V=10+20=30mL,中和掉H+为0.08×0.01=0.0008mol,剩余的H+为0.1×0.02-0.008=0.0012moL,所以最后c(H+)=$\frac{0.0012mol}{0.03L}$=0.04mol/L,
所以pH=-lgc(H+)=-lg0.04=1.4;
答:加入10mLNaOH溶液时,溶液的pH为1.4.
点评 本题考查了酸碱混合溶液的定量计算、pH的计算,题目难度中等,注意把握混合溶液中离子浓度的计算方法,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2中含有6.02×1023个H | B. | 1 mol氧含有6.02×1023个O2 | ||
| C. | 1 mol CaCl2溶液里含有1 mol离子 | D. | 1 mol H+中含有H+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⑧⑨⑩ | B. | ⑦⑧⑨ | C. | ③⑦⑩ | D. | ⑦⑧⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | B. | 胶体粒子直径在1nm~100nm之间 | ||
| C. | 胶体具有丁达尔现象 | D. | 胶体和其它分散系都是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖与银氨溶液反应会产生银镜现象 | |
| B. | 生吃新鲜蔬菜要比熟吃时维生素C的损失小 | |
| C. | 油脂在人体内酶的催化作用下水解为氨基酸 | |
| D. | 不慎误食重金属盐离子,应立即喝大量牛奶来缓解毒性,以减少人体蛋白质中毒的程度 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥ | B. | ②④⑤⑦ | C. | 只有⑤ | D. | 均不对 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 编号 | 热化学方程式 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1=-99kJ•mol-1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 |
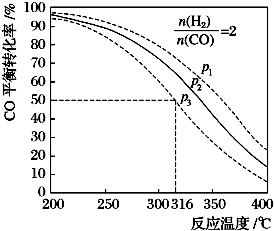
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com