

| A.浓硫酸 | B.稀硫酸 | C.氢氧化钠溶液 | D.硫酸铜溶液 |
科目:高中化学 来源:不详 题型:实验题
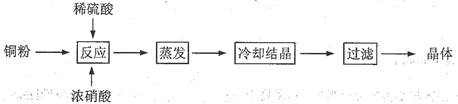
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
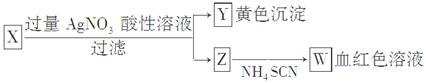
| A.Z中一定有Fe3+ | B.X中一定有Fe2+ |
| C.Y为AgBr沉淀 | D.X一定为FeBr2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
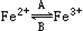 的转化,A中Fe2+做 剂,B中Fe3+做 剂。
的转化,A中Fe2+做 剂,B中Fe3+做 剂。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.5 | B.4 | C.3 | D.2.408×1024 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 中加入过量稀硝酸,得到0.448 L(标准状况下)一种无色气体.写出反应的离子方程式: ,待测溶液中c(Cu2+)= mol/L.
中加入过量稀硝酸,得到0.448 L(标准状况下)一种无色气体.写出反应的离子方程式: ,待测溶液中c(Cu2+)= mol/L.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
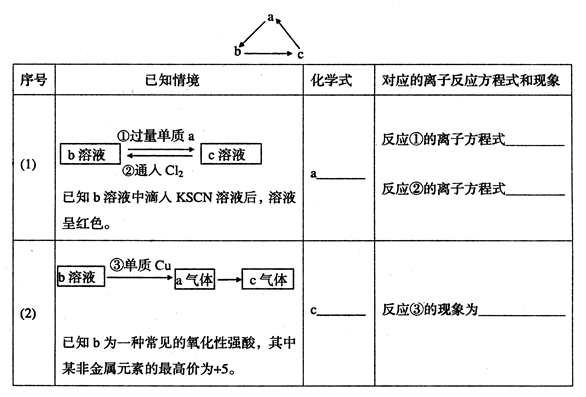
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
| B.氢氧化铁可以由相应的物质通过化合反应而制得 |
| C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI===FeI3+3H2O |
| D.铁元素位于周期表中第4周期ⅧB族 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com