
| A. | 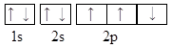 | B. | 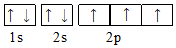 | ||
| C. | 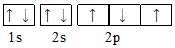 | D. | 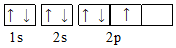 |
科目:高中化学 来源: 题型:选择题
| A. | SiO2和CO2常温都是气体分子 | |
| B. | CO2、SiO2均能和氢氟酸反应 | |
| C. | CO2和SiO2都是酸性氧化物,在一定条件下都能和氧化钙反应 | |
| D. | CO2、SiO2分别是H2CO3、H2SiO3的酸酐,因而均可由CO2、SiO2与水反应制得相应酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4种 | B. | 5种 | C. | 6种 | D. | 7种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | NO中氮氧键 | Cl-Cl键 | Cl-N键 | N=O键 |
| 键能/KJ/mol | 630 | 243 | a | 607 |
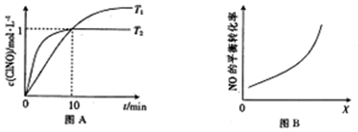
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
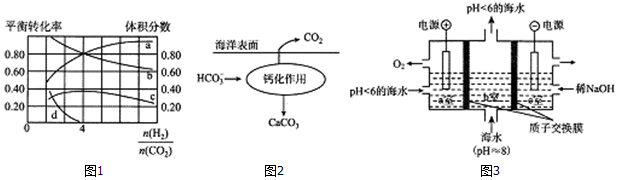
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用漂白精时滴加少量白醋,可提高漂白精的漂白效率 | |
| B. | 用乙醚从黄花篙的汁液中提取青篙素,应用了蒸馏原理 | |
| C. | 古代染坊常用草木灰浸取液来精炼丝绸,该浸取液的主要成分是烧碱 | |
| D. | “地沟油”可用于炼制航空煤油,因为地沟油经过蒸馏可以得到烃类煤油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10Be和9Be是中子数不同质子数相同的不同原子 | |
| B. | 10Be的原子核内中子数比质子数少 | |
| C. | 5.2 g 26Al3+中所含的电子数约为1.2×1024 | |
| D. | 26Al和26Mg的质子数、中子数和核外电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含金属元素的离子可能是阴离子 | |
| B. | 非金属元素组成的化合物可能含有离子键 | |
| C. | 化合物中所含化学键断裂时,一定发生了化学反应 | |
| D. | 用坩埚钳夹住仔细打磨过的铝箔在酒精灯上加热,融化的铝并不滴落 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com