
【题目】能使干燥的有色布条褪色的是
A. 氯气 B. 液氯 C. 氯水 D. 盐酸
 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其他条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
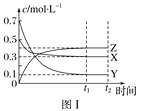
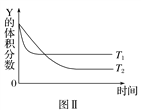
A. 该反应的热化学方程式为X(g)+3Y(g) ![]() 2Z(g) ΔH>0
2Z(g) ΔH>0
B. 若其他条件不变,升高温度,正、逆反应速率均增大,X的转化率增大
C. 温度分别为T1和T2时的平衡常数大小关系为K2>K1
D. 达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛被称为“21世纪金属”
(1)工业上用钛矿石(含FeTiO3,含FeO、Al2O3、SiO2等杂质)经过以下流程制得TiO2:
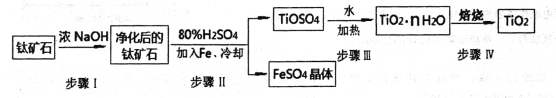
其中,步骤Ⅱ发生反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H20
①步骤I反生的化学方程式是______________________________若将所得FeSO4晶体溶于水,加热蒸干后所得的固体是_________________
②若步骤Ⅲ中是利用Ti4+在溶液中水解制得TiO2·nH2O,则该反应的离子方程式为_________________________________________________
(2)可利用TiO2通过下述两种方法制备金属钛:
方法一:将TiO2作阴极,石墨作阳极,熔融CaO为电解液,用炭块作电解槽池,电解TiO2制得钛,其阴极发生的反应:______________________________________。
方法二:通过以下反应制备金属钛
①TiO2(s)+2Cl2(g) ![]() TiCl4(g)+O2(g) △H=+151 KJ/mol
TiCl4(g)+O2(g) △H=+151 KJ/mol
②TiCl4+2Mg![]() 2MgCl2+Ti
2MgCl2+Ti
在实际生产中,需在反应①过程中加入碳才能顺利制得TiCl4,其原因是_________________________,______________________________________________。(两方面)
(3)若已知:C(s)+O2(g)=CO2(g) △H=-394 KJ/mol,则由固体TiO2、固体C与Cl2反应制取气态TiCl4的热化学方程式为______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于强弱电解质及非电解质的判断完全正确的是
选项 | A | B | C | D |
强电解质 | NaCl | CaCl2 | HNO3 | H2SO4 |
弱电解质 | CH3COOH | BaSO4 | AlCl3 | HF |
非电解质 | Cl2 | CO2 | SO2 | C2H5OH |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.在有机化合物中,每个碳原子周围都有4对共用电子对
B.在有机化合物中,碳原子能形成单键、双键、叁键,还可形成其它形式的共价键
C.在有机化合物中,碳、氢原子之间只能形成单键
D.在有机化合物中,碳、氮原子之间只能形成单键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(kJ)相对大小如图所示。下列有关说法正确的是
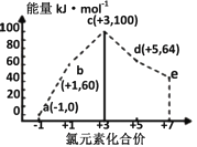
A. a、b、c、d、e中,c最稳定
B. b→a+c反应的活化能为反应物能量减生成物能量
C. b→a+d反应的热化学方程式为:3ClO-(aq)=ClO3-(aq)+2Cl-(aq)ΔH=+116 kJ·mol-1
D. 一定温度下,Cl2与NaOH溶液反应生成的产物有a、b、d,溶液中a、b、d的浓度之比可能为11∶1∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I:已知:反应aA(g)+bB(g) ![]() cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
cC(g),某温度下,在 2 L 的密闭容器中投入一定量的A、B,两种气体的物质的量浓度随时间变化的曲线如图所示。
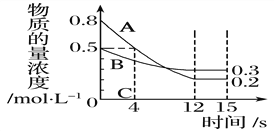
(1)经测定前4 s内v(C)=0.05 mol·L-1·s-1,则该反应的化学方程式为_______________________
(2)若上述反应分别在甲、乙、丙三个相同的密闭容器中进行,经同一段时间后,测得三个容器中的反应速率分别为甲:v(A)=0.3 mol·L-1·s-1; 乙:v(B)=0.12 mol·L-1·s-1; 丙:v(C)=9.6 mol·L-1·min-1,则甲、乙、丙三个容器中反应速率由快到慢的顺序为__________________(用甲、乙、丙表示)。
Ⅱ: 某学生为了探究锌与盐酸反应过程中的速率变化,他在100 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(气体体积已折合成标准状况),实验记录如表(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 | 6 |
氢气体积/mL | 50 | 120 | 224 | 392 | 472 | 502 |
(3)哪一时间段反应速率最大__(填0~1、1~2、2~3、3~4、4~5、5~6 min,下同),原因是_______________________________________________________
(4)如果反应太激烈,为了减缓反应速率而又不减少产生氢气的量,他在盐酸中分别加入等体积的下列溶液,你认为可行的是__________(填字母)
A.CH3COONa B.NaNO3溶液 C.KCl溶液 D.Na2CO3溶液
Ⅲ:(5)下列说法可以证明H2(g)+I2(g)![]() 2HI(g)已达平衡状态的是______________________
2HI(g)已达平衡状态的是______________________
A.单位时间内生成n mol H2的同时,生成n mol HI
B.一个H—H键断裂的同时有两个H—I键断裂
C.温度和体积一定时,混合气体颜色不再变化
D.反应速率v(H2)=v(I2)=![]() v(HI)
v(HI)
E.温度和体积一定时,容器内压强不再变化
F.温度和体积一定时,混合气体的密度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com