
【题目】某含铜样品的主要成分为a CuCO3·bCu(OH)2(a、b均为最简正整数)。为测定其化学组成和Cu元素的质量分数。甲乙两个实验小组查阅资料,设计了不同的实验方案(假定杂质对实验无干扰)。
Ⅰ.甲组同学利用一下方法测定:
①在一定质量的样品中加入过量的稀硫酸,过滤,测量产生气体的体积
②在滤液中加过量的NaOH稀溶液,过滤
③灼烧②中所得滤渣、直至残留固体恒重
(1)为了除去滤渣中的可溶性杂质,需要对滤渣进行的操作是_____,滤渣应在_____(填仪器名称)中进行灼烧。
(2)利用右图装置测量气体体积,读数时应注意:
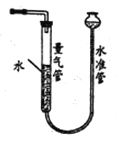
①恢复至室温;②__________;③平视且视线与凹液面最低点相切。
若操作无误,但气体体积测量结果仍然明显偏低,合理的改进措施是____________。
(3)甲组同学在处理实验数据时,将常温常压下测得的气体体积VL换算成V/22.4mol进行计算,则计算所得a值将_______(填“偏大”、“偏小”或“无影响”)。
Ⅱ.乙组同学利用下图装置进行测量(夹持及加热装置略去):
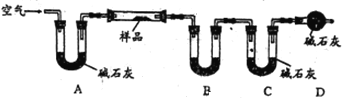
(4)U型管B中的药品是_________,D的作用是_________。
(5)若样品的质量为20g,充分反应后测得B中固体质量增加了0.9g,C中固体质量增加了4.4g,则样品中主要成分的化学式为___________,样品中铜元素的质量分数为____________。
【答案】 洗涤 坩埚 调节量气管和水准管的液面相平 将量气装置中的水换为饱和碳酸氢钠溶液(答案合理即可) 偏大 无水氯化钙(合理即可) 防止空气中的水蒸气和二氧化碳进入装置C,影响测定结果 2CuCO3·Cu(OH)2 48%
【解析】(1)为了除去滤渣中的可溶性杂质,需要对滤渣进行的操作是洗涤,固体应在坩埚中进行灼烧。(2)由于气体体积受压强影响较大,因此读数时应注意:①恢复至室温;②调节量气管和水准管的液面相平 ;③平视且视线与凹液面最低点相切。由于CO2能溶于水,所以需要尽可能减少溶解,改进措施是将量气装置中的水换为饱和碳酸氢钠溶液;(3)常温常压下气体的摩尔体积大于22.4L/mol,因此测得的气体体积VL换算成V/22.4mol进行计算,则计算所得a值将偏大。(4)样品分解产生CO2、水蒸气,所以U型管B中的药品是 无水氯化钙,用来吸收水蒸气。C中碱石灰用来吸收CO2。由于空气中还含有水蒸气和CO2,所以D中碱石灰的作用是防止空气中的水蒸气和二氧化碳进入装置C,影响测定结果。(5)充分反应后测得B中固体质量增加了0.9g,水的物质的量是0.9g÷18g/mol=0.05mol。C中固体质量增加了4.4g,CO2的物质的量是4.4g÷44g/mol=0.1mol,所以a:b=0.1:0.05=2:1,则样品中主要成分的化学式为2CuCO3·Cu(OH)2,样品中铜元素的质量分数为![]() 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】多晶硅是单质硅的一种形态,是制造硅抛光片、太阳能电池及高纯硅制晶的主要原料。已知多晶硅第三代工业制取流程如图所示:
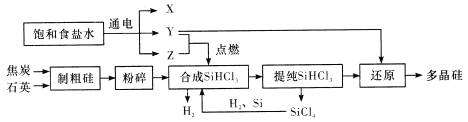
下列说法错误的是
A. Y、Z分别为H2、Cl2
B. 制取粗硅的过程中焦炭与石英会发生副反应生成碳化硅,在该副反应中,氧化剂与还原剂的物质的量之比为1:1
C. SiHCl3极易水解,其完全水解的产物为H2SiO3、H2、HCl,据此推测SiHCl3中硅元素的化合价为+2价
D. Y与SiHCl3制备多晶硅的反应属于置换反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据电解质在溶液中的电离情况,我们划分出了酸、碱、盐,通过学习我们知道酸和碱都有通性,而盐是没有通性的,其本质原因是( )
A.盐不能电离出阳离子
B.盐不能电离出阴离子
C.盐不能电离出H+或OH﹣
D.盐不能电离出共同的离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液的pH关系如下图所示。下列说法正确的是
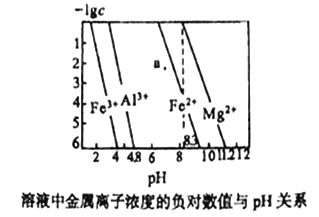
A. a点代表Fe(OH)2饱和溶液
B. Ksp[Fe(OH)3]< Ksp[Al(OH)3]< Ksp[Fe(OH)2]< Ksp[Mg(OH)2]
C. 向0.1mol/L Al3+、Mg2+、Fe2+混合溶液中,逐滴滴加稀NaOH溶液,Mg2+最先沉淀
D. 在pH=7的溶液中,Fe3+、Al3+、Fe2+能大量共存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电离方程式中,错误的是( )
A.H2CO3H++HCO3﹣; HCO3﹣H++CO32﹣
B.H2SO4═2H++SO42﹣
C.NaHS═Na++H++S2﹣
D.CH3COOHH++CH3COO﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前工业上有一种方法是用CO2生产燃料甲醇(CH3OH)。一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应过程中能量(单位为kJ·mol—1)的变化。
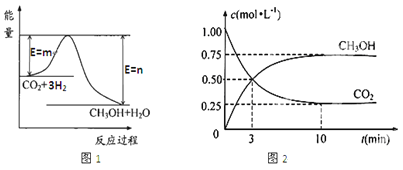
(1)该反应为_________热反应,原因是_____________________。
(2)下列能说明该反应已经达到平衡状态的是_________(填序号)
A.v (H2)=3v(CO2) B.容器内气体压强保持不变
C.v逆(CO2)=v正(CH3OH) D.容器内气体密度保持不变
E.CH3OH 中1 mol H—O键断裂的同时2 mol C=O键断裂
F. 混合气体的平均摩尔质量不变
(3)在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=________。 达平衡时容器内平衡时与起始时的压强比____________。
(4)甲醇、氧气在酸性条件下可构成燃料电池,其负极的电极反应为________________,
与铅蓄电池相比,当消耗相同质量的负极物质时,甲醇燃料电池的理论放电量是铅蓄电池的___________倍(保留小数点后1位)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1NaOH溶液分别滴定20.00 mL浓度均为 0.10mol L-1的CH3COOH(Ka=1.75×10-5)溶液和HCN (Ka=4.9×10-10)溶液所得滴定曲线如图。下列说法正确的是

A. 曲线I和曲线Ⅱ分别代表的是CH3COOH和HCN
B. 点③和点⑤所示溶液中:c(CN-)=c(CH3COO-)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 在点②和③之间(不包括端点)存在关系: c(Na+)>c(A-)>c(H+)>c(OH-) (A-代表溶液中的酸根离子)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,有关说法不正确的是( )
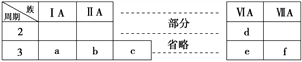
A. 元素b的单质不能与酸性氧化物发生化学反应
B. a、b、d、f四种元素的离子半径:f>d>a>b
C. 元素c的氧化物既能与酸反应又能与碱反应
D. a、c、e的最高价氧化物对应的水化物之间能够相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质结构说法正确的是
A. 氯化钠固体中的离子键在溶于水时被破坏
B. 碘升华时克服了共价键和分子间作用力
C. 含极性键的共价化合物一定是电解质
D. HF的分子间作用力大于HCl,故HF比HCl更稳定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com