
【题目】(1)同温同压下,![]() 与
与![]() (均为气体),它们的体积之比为_____________,它们的质量之比为_____________。
(均为气体),它们的体积之比为_____________,它们的质量之比为_____________。
(2)3.80g![]() 含有0.08mol
含有0.08mol![]() ,
,![]() 的摩尔质量为_____________,若M原子中质子数与中子数相等,该物质的化学式为_____________。
的摩尔质量为_____________,若M原子中质子数与中子数相等,该物质的化学式为_____________。
(3)某化学社团的同学对仅由两种元素组成的化合物X进行研究,实验过程形成如图示:
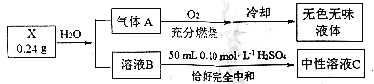
已知:A为单质,B的焰色反应只显示黄色。
写出X与水反应的化学方程式_______________________________________。
【答案】2:3 1:1 ![]() MgCl2
MgCl2 ![]()
【解析】
(1)同温同压下,气体的摩尔体积相同,根据m=nM进行计算比较;
(2)摩尔质量=![]() ;质子数+中子数=质量数;
;质子数+中子数=质量数;
(3)B的焰色反应只显示黄色说明含有Na元素,能与50mL0.1mol/L的硫酸溶液恰好中和说明B溶液显碱性;气体A在氧气中燃烧生成无色无味液体,可推测A为氢气,所以X所含的两种元素为H和Na,可先猜测其化学式为NaH,则 0.24gNaH的物质的量为![]() ,生成的B溶液为氢氧化钠,氢氧化钠的物质的量为0.01mol,50mL0.1mol/L的硫酸溶液中氢离子物质的量为0.01mol,恰好与氢氧化钠完全反应,符合题意,即猜想成立,X为NaH。
,生成的B溶液为氢氧化钠,氢氧化钠的物质的量为0.01mol,50mL0.1mol/L的硫酸溶液中氢离子物质的量为0.01mol,恰好与氢氧化钠完全反应,符合题意,即猜想成立,X为NaH。
(1)同温同压下,气体的摩尔体积相同,所以体积之比等于物质的量之比,![]() 与
与![]() (均为气体),它们的体积之比为0.4:0.6=2:3;
(均为气体),它们的体积之比为0.4:0.6=2:3;![]() 的质量为0.4mol×48g/mol=19.2g,
的质量为0.4mol×48g/mol=19.2g,![]() 的质量为0.6mol×32g/mol=19.2g它们的质量之比为1:1。
的质量为0.6mol×32g/mol=19.2g它们的质量之比为1:1。
(2)3.80g![]() 含有0.08mol
含有0.08mol![]() ,则
,则![]() 的物质的量为0.04mol,
的物质的量为0.04mol,![]() 的摩尔质量=
的摩尔质量=![]() ,M的质量数为95-35.5×2=24,M原子中质子数与中子数相等,质量数=质子数+中子数,所以该原子的质子数为12,即Mg,所以物质的化学式为MgCl2;
,M的质量数为95-35.5×2=24,M原子中质子数与中子数相等,质量数=质子数+中子数,所以该原子的质子数为12,即Mg,所以物质的化学式为MgCl2;
(3)根据分析可知X为NaH,其与水反应生成氢氧化钠和氢气,方程式为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、U、W五种短周期非金属元素,它们的原子半径与原子序数有如图关系,化合物XZ是水煤气的主要成分之一,下列说法不正确的是( )
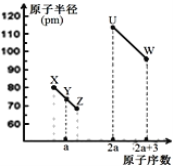
A.U、X、W三种元素最高价含氧酸酸性依次增强
B.由Y、Z和氢三种元素形成的化合物中一定只含共价键
C.XZ2与X60的化学键类型和晶体类型都相同
D.1molU的氧化物中含4NA个共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出指定物质对应的化学式。消毒剂碘伏中含有碘分子_____________,胶卷中必不可少的感光材料_____________,加碘盐中含有碘酸钾_____________,发酵粉含有小苏打_____________。
(2)化工厂镁着火,不能用二氧化碳灭火,用化学方程式解释__________________________。
(3)电解饱和食盐水是氯碱工业的基础,写出化学方程式__________________________。
(4)稀醋酸处理热水瓶中水垢(主要成分为碳酸钙)的离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
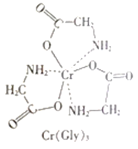
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则NO2的大
),则NO2的大![]() 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
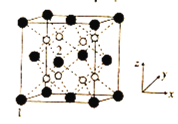
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),则原子坐标为(
),则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )间的距离为__pm。
)间的距离为__pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定乙醇分子(C2H6O)中活泼氢原子个数,采用下列装置,通过测定乙醇与金属钠反应放出氢气的多少进行计算。
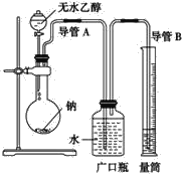
(1)指出实验装置中的错误:__。
(2)若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将__(填“偏大”、“偏小”或“不变”)。
(3)请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.5 g含杂质的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一种杂质,则杂质不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将32.64 g铜与140 mL一定浓度的硝酸反应,铜完全溶解,产生的NO和NO2混合气体在标准状况下的体积为11.2 L。请回答下列问题:
(1)NO的体积为________L,NO2的体积为________L。
(2)参加反应的HNO3的物质的量是________。
(3)待产生的气体全部释放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,则原硝酸溶液的浓度为________mol·L-1。
(4)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要30%的双氧水________g。
(5)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,至少需要通O2______mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com