
【题目】
对羟基苯甲酸丁脂(俗称尼泊金丁酯)可用作防腐剂,对酵母和霉菌有很强的抑制作用,工业上常用对羟基苯甲酸与丁醇在浓硫酸催化下进行酯化反应而制得,以下是某课题组开发的从廉价、易得的化工原料出发制备对羟基苯酸丁酯的合成路线:

已知以下信息:
通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;D可与银氨溶液反应生成银镜; F的核磁共振氢谱表明其有两种不同化学环境的氢,且峰面积比为1∶1。回答下列问题:
(1)A的化学名称为__________;
(2)由B生成C的化学反应万程式为_____________________,该反应的类型为__________;
(3)D的结构简式为__________;
(4)F的分子式为__________;
(5)G的结构简式为__________;
(6)E的同分异构体中含有苯环且能发生银镜反应的共有__________种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2∶2∶1的是_____________(写结构简式)。
【答案】 甲苯 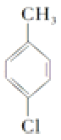 +2Cl2
+2Cl2 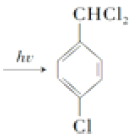 +2HCl 取代反应
+2HCl 取代反应 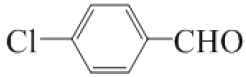 C7H4O3Na2
C7H4O3Na2 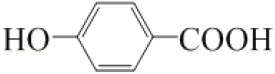 13
13 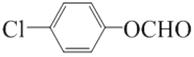
【解析】由A的分子式为C7H8,最终合成对羟基苯甲酸丁酯可知,A为甲苯![]() ,甲苯在铁作催化剂条件下,苯环甲基对位上的H原子与氯气发生取代反应生成B,B为
,甲苯在铁作催化剂条件下,苯环甲基对位上的H原子与氯气发生取代反应生成B,B为![]() ,结合已知信息可知,D中含有醛基,在光照条件下,B中甲基上的H原子与氯气发生取代反应生成C,C为
,结合已知信息可知,D中含有醛基,在光照条件下,B中甲基上的H原子与氯气发生取代反应生成C,C为![]() ,在氢氧化钠水溶液中,C中甲基上的氯原子发生取代反应生成D, D为
,在氢氧化钠水溶液中,C中甲基上的氯原子发生取代反应生成D, D为![]() ,D在催化剂条件下醛基被氧化生成E,E为
,D在催化剂条件下醛基被氧化生成E,E为![]() ,在碱性和高温高压的条件下,结合已知信息可知,苯环上的Cl原子被取代,同时与氢氧化钠发生反应生成F,F为
,在碱性和高温高压的条件下,结合已知信息可知,苯环上的Cl原子被取代,同时与氢氧化钠发生反应生成F,F为![]() ,F经酸化生成对羟基苯甲酸G
,F经酸化生成对羟基苯甲酸G![]() 。
。
(1). 由以上分析可知A的化学名称为甲苯,故答案为:甲苯;
(2). B为![]() ,与氯气在光照条件下发生取代反应生成
,与氯气在光照条件下发生取代反应生成![]() ,方程式为
,方程式为![]() +2Cl2
+2Cl2  +2HCl,故答案为:
+2HCl,故答案为:![]() +2Cl2
+2Cl2  +2HCl;取代反应;
+2HCl;取代反应;
(3). 由以上分析可知D为![]() ,故答案为:
,故答案为:![]() ;
;
(4). F为![]() ,分子式为C7H4O3Na2,故答案为:C7H4O3Na2;
,分子式为C7H4O3Na2,故答案为:C7H4O3Na2;
(5). 由以上分析可知G为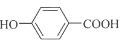 ;
;
(6). E为![]() ,同分异构体中含有苯环且能发生银镜反应,说明分子中含有醛基,若取代基为-OOCH、-Cl,有邻、间、对三种结构,若取代基为-CHO、-OH、-Cl,当-CHO、-OH处于邻位时,-Cl有4种位置,当-CHO、-OH处于间位时,-Cl有4种位置,当-CHO、-OH处于对位时,-Cl有2种位置,符合条件的同分异构体共有3+4+4+2=13种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2∶2∶1的是
,同分异构体中含有苯环且能发生银镜反应,说明分子中含有醛基,若取代基为-OOCH、-Cl,有邻、间、对三种结构,若取代基为-CHO、-OH、-Cl,当-CHO、-OH处于邻位时,-Cl有4种位置,当-CHO、-OH处于间位时,-Cl有4种位置,当-CHO、-OH处于对位时,-Cl有2种位置,符合条件的同分异构体共有3+4+4+2=13种,其中核磁共振氢谱有三种不同化学环境的氢,且峰面积比为2∶2∶1的是![]() ,故答案为:13;
,故答案为:13;![]() 。
。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A. 将1mol Cl2 通入足量水中,溶液中HC1O、Cl-、ClO- 粒子数之和为2NA
B. 100g CaCO3晶体和100g KHCO3晶体中含有的离子数分别为2NA和3NA
C. 标准状况下,4.48L NO 和2.24L O2 混合后,原子总数为0.6NA
D. 已知3BrF3 + 5H2O= HBrO3 + Br2 + 9HF + O2↑,若有5mol H2O 参加反应,则被水还原的BrF3分子数目为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】胶体区别于其他分散系的本质特征( )
A.胶体的分散质能通过滤纸空隙,而浊液的分散质不能
B.产生丁达尔现象
C.胶体在一定条件下能稳定存在
D.分散质粒子直径在1~100nm之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
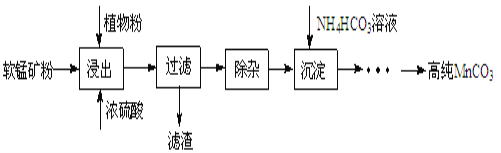
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时,植物粉的作用是_____。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是_____;
操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式_____。
(3)制备:在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____;该反应的化学方程式为_____;生成的MnCO3沉淀需经充分洗涤,洗涤的操作方法是_____。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。___________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有如下合成路线,甲经二步转化为丙:
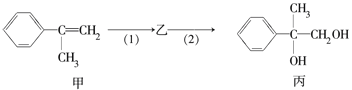
下列叙述错误的是
A. 甲和丙均可与酸性KMnO4溶液发生反应
B. 反应(1)的无机试剂是液溴,铁作催化剂
C. 步骤(2)产物中可能含有未反应的甲,可用溴水检验是否含甲
D. 反应(2)属于取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z 为原子序数 1~20 号内的元素,将 4.7g X 的最高价氧化物X2O溶于 95.3g 水中,所 得溶液浓度为 5.6% 。Y 元素原子与 X 元素原子的最外电子层电子数相同,12g Y 的氢氧化物恰好被0.75 mol/L 的盐酸 400mL 所中和。Z、Y 的原子核外电子层数相同,16g ZO2气体在标准状况下的体积 为 5.6L。试求 X、Y、Z 元素名称。X______________,Y_______________,Z____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容密闭容器中发生反应NH2COONH4(s)2NH3(g)+CO2(g),不能判断该反应已达到化学平衡的是( )
A. v正(NH3)=2v逆(CO2) B. 密闭容器中混合气体的平均摩尔质量不变
C. 密闭容器中混合气体的密度不变 D. 密闭容器中总压强不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
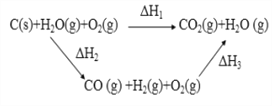
A. ΔH1=ΔH2+ΔH3
B. ΔH1<0 、 ΔH2>0 、 ΔH3<0
C. 将煤转化为 H2(g) 和 CO(g)后燃烧比煤直接燃烧放出热量多
D. 将煤转化为水煤气后再燃烧,从提高煤燃烧利用率看是得不偿失
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com