
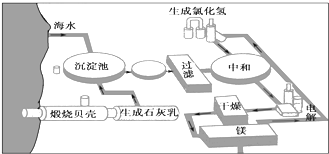
 如图是工业上生产镁的流程.
如图是工业上生产镁的流程.
| ||
| ||


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案 走进文言文系列答案
走进文言文系列答案科目:高中化学 来源: 题型:
| A、纸层析法适用于分离和检验化学性质十分相近的物质 |
| B、用纸层析法可以检验氯化铁溶液中是否混有少量氯化铜 |
| C、配制时试样溶液的浓度较大,点样时试样点斑较小 |
| D、为了看到色斑,只有有色离子的检验才可以用纸层析法 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③④ | B、③④①② |
| C、①③④② | D、①③②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度 | K1 | K2 |
| 973K | 1.47 | 2.38 |
| 1173K | 2.15 | 1.67 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置,已知两电极上发生的电极反应分别为:
如图装置,已知两电极上发生的电极反应分别为:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com