
| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度/(mol•L-1) | 0.44 | 0.6 | 0.6 |
分析 (1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2;
(2)利用盖斯定律结合已知反应的热方程式计算;
(3)①根据Qc=$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$计算,然后比较与k的大小,再判断反应方向;
②根据方程式计算平衡常数,然后利用三段式法解答;
③当化学反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再发生变化,根据密度和平均相对分子质量的公式进行分析解答该题.
解答 解:(1)煤的气化是利用煤与水蒸气高温条件小反应,生成CO和H2的过程:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2,
故答案为:C+H2O$\frac{\underline{\;高温\;}}{\;}$CO+H2;
(2)由盖斯定律可知,通过①×2+②+③可得所求反应方程式,则△H=-90.8kJ/mol×2-23.5kJ/mol-41.3kJ/mol=-246.4kJ/mol,一定条件下的密闭容器中,该总反应达到平衡,要提高CO的转化率,应使平衡向正反应方向移动,可减少CO2的浓度或分离出二甲醚,由于反应放热,升高温度平衡向逆反应方向移动,转化率减小,催化剂不影响平衡移动,而增加CO的浓度,CO的转化率反而减小;
故答案为:-246.4 kJ•mol-1;c、e;
(3)①Qc=$\frac{c(C{H}_{3}OC{H}_{3})×c({H}_{2}O)}{{c}^{2}(C{H}_{3}OH)}$=$\frac{0.6×0.6}{0.4{4}^{2}}$=1.86<400,故反应向正反应方向进行,正反应速率大于逆反应速率,
故答案为:>;
②2CH3OH(g)≒CH3OCH3(g)+H2O(g)
某时刻浓度(mol•L-1):0.44 0.6 0.6
转化浓度(mol•L-1):2x x x
平衡浓度(mol•L-1):0.44-2x 0.6+x 0.6+x
K=$\frac{(0.6+x)^{2}}{(0.44-2x)^{2}}$,解得x=0.2mol/L,
故平衡时c(CH3OH)=0.44mol/L-0.2mol/L×2=0.04mol/L,
起始时在密闭容器中加入CH3OH,
则起始时甲醇的浓度为0.44moL/L+0.6mol/L×2=1.64mol/L,平衡时c(CH3OH)=0.04mol/L,
则10min转化甲醇1.64moL/L-0.04moL/L=1.6mol/L,
所以甲醇的反应速率为v(CH3OH)=$\frac{1.6mol/L}{10min}$=0.16 mol/(L•min),
故答案为:0.04 mol•L-1; 0.16 mol/(L•min);
③A.反应物和生成物中气体的计量数之和相等,容器中压强不变,不能证明达到了平衡状态,故A错误;
B.反应前后气体的体积和质量均不变,所以密度始终不会变化,所以混合气体的密度不再变化不能说明达到了平衡状态,故B错误;
C.CH3OH与H2O的浓度之比为1:2,不能说明反应物的浓度保持不变,所以不能说明达到了平衡状态,故C错误;
D.单位时间内,消耗2mol CH3OH表示正反应速率,同时消耗1molH2O表示逆反应速率,而且正逆速率之比等于计量数之比,所以能说明反应达到平衡状态,故D正确;
故答案为:D.
点评 本题考查综合考查了化学平衡的有关知识,题目难度中等,注意“始、转、平”是解决有关化学平衡的“三段论”解题法,当三组量一旦确定,可以解答有关平衡的平衡常数计算、转化率、反应速率、平衡时成分的体积分数等的关键.


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:解答题
| X | Y | |
| Z | W | |
| T |
 (写电子式);
(写电子式);查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 分子中,一定在同一平面内的碳原子数为a,一定在同一直线上的碳原子数为b,处于四面体结构中心的碳原子数为c.则a,b,c依次为( )
分子中,一定在同一平面内的碳原子数为a,一定在同一直线上的碳原子数为b,处于四面体结构中心的碳原子数为c.则a,b,c依次为( )| A. | 4,5,3 | B. | 4,6,3 | C. | 6,3,4 | D. | 4,4,6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
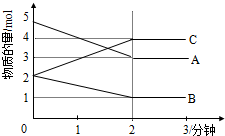 某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色).
某反应在体积为5L的恒容密闭容器中进行,在0-3分钟内各物质的量的变化情况如图所示(A,B,C均为气体,且A气体有颜色).查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com