
分析 根据n=$\frac{V}{{V}_{m}}$计算224LHCl的物质的量,再根据m=nM计算HCl的质量,根据m=ρV计算水的质量,进而计算溶液的质量,根据ω(HCl)=$\frac{HCl的质量}{溶液质量}$×100%计算盐酸的质量分数,再根据c=$\frac{1000ρω}{M}$计算盐酸的物质的量浓度,根据稀释定律,稀释前后溶质HCl的物质的量不变,据此计算稀释后盐酸的浓度.
解答 解:标准状况下,将224L HCl气体的物质的量为$\frac{224L}{22.4L/mol}$=10mol,故HCl的质量为10mol×36.5g/mol=365g,
635mL水的质量为635mL×1g/mL=635g,故HCl的质量分数为$\frac{365g}{365g+635g}$×100%=36.5%,故所得盐酸的物质的量浓度为$\frac{1000×1.19×36.5%}{36.5}$mol/L=11.9mol/L,
根据稀释定律,稀释前后溶质HCl的物质的量不变,令稀释后稀盐酸的浓度为c,则:
11.9mol/L×0.01L=c×1.19L
解得c=0.1mol/L,
答:所得盐酸的质量分数为36.5%,稀释后所得稀盐酸的物质的量浓度0.1mol/L.
点评 本题考查物质的量浓度、质量分数的有关计算等,理解掌握质量分数与物质的量浓度之间关系,注意对概念的理解与公式的灵活运用.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:选择题
| A. | NaN3是还原剂 | |
| B. | 氧化产物与还原产物物质的量之比为1:15 | |
| C. | N2既是氧化产物又是还原产物 | |
| D. | 标准状况下,当有10mol电子转移时生成358.4L N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25mL | B. | 250mL | C. | 50mL | D. | 500mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
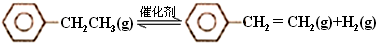
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | 612 | 436 |
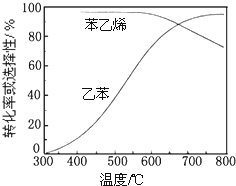
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
有A、B、C、D、E、F、G七种元素,原子序数依次增大,A、B、C、D、E均为短周期元素,D、F为生活中的常见金属元素.A元素原子核内只有一个质子,元素A与B形成的气态化合物甲在标准状况下的密度为0.714g•L-1,C元素原子的最外层电子数是其电子层数的3倍,G长期暴露在空气中表面变绿.E与C同主族.均含D元素的乙(金属阳离子)、丙、丁微粒间的转化全为非氧化还原反应,均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓度分别为2 mol/L和1 mol/L的Na2CO3溶液中,C(CO32一)的比值为2:1 | |
| B. | 常温常压下,16 g 02和O3混合气体中含有NA个氧原子 | |
| C. | 46 g NO2和N204混合气体的物质的量之和大于O.5 mol,小于l mol | |
| D. | 向饱和CuS04溶液中加入1 mol CuS04固体,则析出的晶体的质量大于250 g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
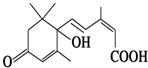 北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.
北京奥运会期间对大量盆栽鲜花施用了S诱抗素制剂,以保持鲜花盛开.S诱抗素的分子结构如图,根据S诱抗素结构,可知S诱抗素分子中含有的官能团有羰基、碳碳双键、羟基、羧基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com