
 已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.下列说法不正确的是( )
已知溶液中:还原性HSO3->I-,氧化性IO3->I2>SO42-.在含3molNaHSO3的溶液中逐滴加入KIO3溶液,加入的KIO3和析出的I2的物质的量的关系曲线如图所示.下列说法不正确的是( )| A. | a点反应的离子方程式为 IO3-+3HSO3-=I-+3SO42-+3H+ | |
| B. | b点到c点反应的离子方程式为 IO3-+5I-+6H+=3I2+3H2O | |
| C. | 当溶液中的I-为0.4 mol时,加入的KIO3只能为0.4 mol | |
| D. | 若往100 mL 1mol/L的KIO3溶液中逐滴滴加NaHSO3溶液,反应开始时的离子方程式为 2IO3-+5HSO3-=I2+5SO42-+H2O+3H+ |
分析 原性HSO-3>I-,所以首先是发生以下反应离子方程式:IO3-+3HSO3-═I-+3SO42-+3H+,继续加入KIO3,氧化性IO-3>I2,所以IO3-可以结合H+氧化I-生成I2,离子方程式是IO3-+6H++5I-═3H2O+3I2,根据发生的反应来判断各个点的产物,以此解答该题.
解答 解:A.0~b间没有碘单质生成,说明碘酸根离子和亚硫酸氢根离子发生氧化还原反应生成碘离子,加入碘酸钾的物质的量是1mol,亚硫酸氢钠的物质的量是3mol,亚硫酸氢根被氧化生成硫酸根离子,根据转移电子守恒知,生成碘离子,d点发生的离子方程式为:3HSO3-+IO3-═3SO42-+I-+3H+,故A正确;
B.根据图象知,b-c段内发生IO3-+6H++5I-═3H2O+3I2,故B正确;
C.如发生IO3-+3HSO3-═I-+3SO42-+3H+,则当溶液中的I-为0.4 mol时,加入的KIO3为0.4mol,如先发生IO3-+3HSO3-═I-+3SO42-+3H+,再发生IO3-+6H++5I-═3H2O+3I2,加入的KIO3为1mol+0.12mol=1.12mol,故C错误;
D.向100mL 1mol/L的KIO3溶液中滴加NaHSO3溶液,HSO3-被氧化为SO42-,KIO3过量,由于氧化性IO-3>I2,KIO3将氧化为I-,反应不能生成I-,而是生成I2,反应离子方程式为:2IO3-+5HSO3-=I2+5SO42-+3H++H2O,故D正确.
故选C.
点评 本题考查氧化还原反应,为高频考点,明确氧化性、还原性强弱及发生反应的先后顺序是解本题关键,易错点是C,注意结合原子守恒计算,题目难度中等.


科目:高中化学 来源: 题型:实验题
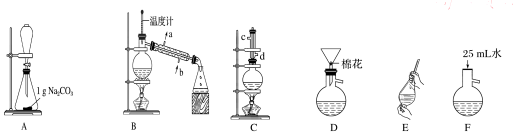
| 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 水溶性 | |
| 苯甲酸 | 122.4 | 249 | 1.27 | 微溶 |
| 甲醇 | -97 | 64.3 | 0.79 | 互溶 |
| 苯甲酸甲酯 | -12.3 | 199.6 | 1.09 | 不溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe2+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2常用于自来水消毒 | |
| B. | SO2常用于漂白食品 | |
| C. | 乙烯可以调节植物生长 | |
| D. | Na2O2可用于呼吸面具中氧气的来源 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100g质量分数为98%的浓硫酸中所含有的氧原子数为4NA | |
| B. | 足量的Fe与6.72LCl2反应转移的电子数为0.6NA | |
| C. | 密闭容器中1molN2与4molH2反应生成的NH3分子数小于2NA | |
| D. | 3g乙烷含有共用电子对为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol•L-1氨水中加几滴酚酞,再加等体积的醋酸铵溶液,观察红色是否变浅 | |
| B. | 测定0.1 mol•L-1NH4C1溶液的酸碱性 | |
| C. | 测定0.lmol•L-1氨水的pH | |
| D. | 比较浓度均为0.1 mol•L -1的氨水与NaOH溶液的导电能力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:
,从而具有胶黏性,某种氰基丙烯酸酯(G)的合成路线如下:

 ,
, +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$ +NaCl.
+NaCl.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )
X、Y、Z、W是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示.已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1.下列说法正确的是( )| A. | X单质与Z单质与食盐溶液中构成原电池,Z的单质被氧化 | |
| B. | Y、W的最简单氢化物的水溶液能相互反应 | |
| C. | X、W可形成离子化合物XW | |
| D. | W形成含氧酸为强酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com