有机化学知识在生活中应用广泛.
(1)糖类、油脂和蛋白质是动物性和植物性食物中的基本营养物质.
①下列有关说法中,正确的是
BCEF
BCEF
;
A.棉、麻、木材、蚕丝的主要成分都是纤维素
B.油脂是产生能量最高的营养物质
C.蛋白质在人体内发生水解最终生成氨基酸
D.糖类都是有甜味的物质
E.淀粉、纤维素、蛋白质都是天然高分子化合物
F.硫酸铵或乙酸铅溶液加入到蛋白质溶液中,蛋白质都能从溶液中析出
②葡萄糖是最重要、最简单的单糖,除了是一种营养物质,还能用在制镜等工业上.写出葡萄糖发生银镜反应的化学方程式:
CH
2OH(CHOH)
4CHO+2Ag(NH
3)
2OH
2Ag↓+CH
2OH(CHOH)
4COONH
4+3NH
3+H
2O
CH
2OH(CHOH)
4CHO+2Ag(NH
3)
2OH
2Ag↓+CH
2OH(CHOH)
4COONH
4+3NH
3+H
2O
.
(2)苹果酸常用作汽水、糖果的添加剂,其结构简式为
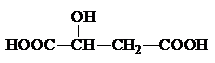
,该分子中官能团的名称为
羧基,羟基
羧基,羟基
,可以和醇类物质发生
酯化
酯化
反应,还可以发生分子内脱水生成马来酸,马来酸能使溴水褪色,则马来酸的结构简式为
HOOC-CH=CH-COOH
HOOC-CH=CH-COOH
.
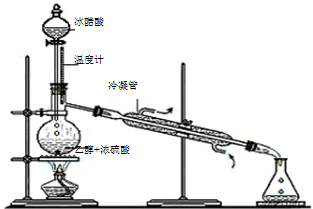
(3)实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏(如图1所示),得到含有乙醇、乙酸和水的乙酸乙酯粗产品.请回答下列问题:(已知:乙醇、乙酸、乙酸乙酯的沸点依次是78.4℃、118℃、77.1℃)
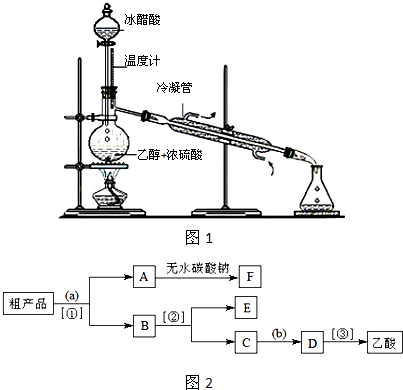
①在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入几块碎瓷片,其目的是
防止烧瓶中的液体暴沸
防止烧瓶中的液体暴沸
;
②生成乙酸乙酯的反应是可逆反应,反应物不能完全变成生成物,反应一段时间后,就达到了该反应的限度,即达到化学平衡状态.下列描述能说明该反应已达到化学平衡状态的有(填序号)
BDE
BDE
;
A.单位时间里,生成1mol乙酸乙酯,同时生成1mol水
B.单位时间里,生成1mol乙酸乙酯,同时生成1mol乙酸
C.单位时间里,消耗1mol乙醇,同时消耗1mol乙酸
D.正反应的速率与逆反应的速率相等
E.混合物中各物质的浓度不再变化
③现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图2所示是分离操作步骤流程图.
试剂a是
饱和Na2CO3溶液
饱和Na2CO3溶液
,分离方法①是
分液
分液
;分离方法②是
蒸馏
蒸馏
,试剂b是
(浓)硫酸
(浓)硫酸
;
④写出C→D 反应的化学方程式
2CH3COONa+H2SO4→2CH3COOH+Na2SO4
2CH3COONa+H2SO4→2CH3COOH+Na2SO4
.

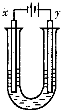
 是一种液体,沸点77℃.在盛有20mL蒸馏水的锥形中,小心滴加8~10滴的
是一种液体,沸点77℃.在盛有20mL蒸馏水的锥形中,小心滴加8~10滴的 ,可观察到反应剧烈,液面上有白雾生成,并有刺激性气味的无色气体逸出,该气体可使品红试纸褪色.轻轻振荡锥形瓶,待白雾消失后,往溶掖中滴加
,可观察到反应剧烈,液面上有白雾生成,并有刺激性气味的无色气体逸出,该气体可使品红试纸褪色.轻轻振荡锥形瓶,待白雾消失后,往溶掖中滴加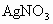 溶液,有白色沉淀生成,再滴加稀
溶液,有白色沉淀生成,再滴加稀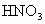 ,白色沉淀不消失.根据实验现象写出
,白色沉淀不消失.根据实验现象写出 与水反应的化学方程式:___________________.
与水反应的化学方程式:___________________. 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案
 Al(OH)3+OH-
Al(OH)3+OH- Al(OH)3+OH-
Al(OH)3+OH-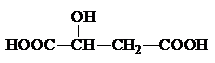 ,该分子中官能团的名称为
,该分子中官能团的名称为

 有机化学知识在生活中应用广泛.
有机化学知识在生活中应用广泛.
 到
到