
| A. | 浓硝酸 | B. | 稀硝酸 | C. | 浓盐酸 | D. | 食用醋 |
分析 溶液可用铝制容器盛装,该溶液不能与Al反应或发生钝化现象.
解答 解:A、在常温下,浓硝酸具有“强氧化性”,可以在铝制器皿表明形成一层致密的氧化物薄膜,阻止酸和金属的继续接触,可以用铝制容器盛装浓硝酸,故A正确;
B、金属铝和稀硝酸反应,铝被腐蚀,不能用铝制容器盛装稀硝酸,故B错误;
C、铝与盐酸反应生成氯化铝与氢气,铝被腐蚀,不能用铝制容器盛装盐酸,故C错误;
D、食用醋主要成分为醋酸,铝与醋酸溶液反应,铝被腐蚀,不能用铝制容器盛装醋酸溶液,故D错误;
故选A.
点评 本题考查Al与硝酸等物质的性质,注意在常温下,浓硝酸和浓硫酸具有“强氧化性”,可以在铁或者铝表面形成一层致密的氧化物薄膜,阻止酸和金属的继续接触,发生钝化,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | Na3N与盐酸反应生成的都是盐 | |
| B. | Na+和N3-的电子层结构不相同 | |
| C. | Na+的半径大于N3-的半径 | |
| D. | 在Na3N与水的反应中,Na3N做还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X 的氧化物的水化物可能有两种 | B. | .单质是能导电的固体 | ||
| C. | 单质不能与氢气直接化合 | D. | X 是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
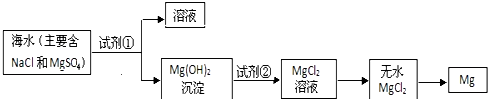
| 学生观点 | 是否正确 | 简述理由 |
| 观点 1 | 否 | 海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀 |
| 观点 2 | 否 | 能源消耗大,海水的综合利用低,成本高 |
| 观点 3 | 是 | 镁离子富集浓度高,成本低 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:W>X>Y>Z | B. | 原子半径:W>X>Y>Z | ||
| C. | W的最高价氢氧化物的碱性比X弱 | D. | Y的最简单氢化物的稳定性比Z的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
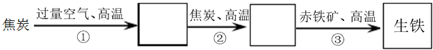
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单位时间内生成2mol H2的同时消耗了1mol CO | |
| B. | c(CO):c(CH3OH)=1:1 | |
| C. | 在恒温恒容的容器中,混合气体的压强保持不变 | |
| D. | 在绝热恒容的容器中,反应的平衡常数不再变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
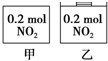 甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )
甲、乙两个容器中最初存在的物质及数量如图所示,两个容器最初的容积相等、温度相同,反应中甲的容积不变,乙中的压强不变,在一定温度下反应达到平衡.下列说法正确的是( )| A. | 平衡时各容器内c(NO2)的大小顺序为乙>甲 | |
| B. | 平衡时N2O4的百分含量:乙>甲 | |
| C. | 平衡时甲中的压强与乙中的压强:甲>乙 | |
| D. | 平衡时混合物的平均相对分子质量:甲>乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com