
有机物甲能发生银镜反应,甲催化加氢还原成有机物乙,1 mol乙与足量金属钠反应放出标准状况下H2 22.4 L,则乙一定不是( )
A.HOCH2CH2OH
B.CH3CH2CH2OH
C.HOCH2CH(OH)CH3
D.CH3CH(OH)CH2CH2OH
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下表是稀硫酸与某金属反应的实验数据:
| 实验 序号 | 金属质量/g | 金属状态 | c(H2SO4) /mol·L-1 | V(H2SO4溶液)/mL | 溶液温度/℃ | 金属消失的时间/s | |
| 反应前 | 反应后 | ||||||
| 1 | 0.10 | 丝 | 0.5 | 50 | 20 | 34 | 500 |
| 2 | 0.10 | 粉末 | 0.5 | 50 | 20 | 35 | 50 |
| 3 | 0.10 | 丝 | 0.7 | 50 | 20 | 36 | 250 |
| 4 | 0.10 | 丝 | 0.8 | 50 | 20 | 35 | 200 |
| 5 | 0.10 | 粉末 | 0.8 | 50 | 20 | 36 | 25 |
| 6 | 0.10 | 丝 | 1.0 | 50 | 20 | 35 | 125 |
| 7 | 0.10 | 丝 | 1.0 | 50 | 35 | 50 | 50 |
| 8 | 0.10 | 丝 | 1.1 | 50 | 20 | 34 | 100 |
| 9 | 0.10 | 丝 | 1.1 | 50 | 30 | 44 | 40 |
分析上述数据,回答下列问题:
(1)实验4和5表明,____________________对反应速率有影响,____________,反应速率越快,能表明同一规律的实验还有________(填实验序号)。
(2)仅表明反应物浓度对反应速率产生影响的实验有__________________(填实验序号)。
(3)本实验中影响反应速率的其他因素还有________,其实验序号是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关天然产物水解的叙述不正确的是( )
A.油脂水解可得到丙三醇
B.可用碘检验淀粉是否水解完全
C.蛋白质水解的最终产物均为氨基酸
D.纤维素水解与淀粉水解得到的最终产物不同
查看答案和解析>>
科目:高中化学 来源: 题型:
在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应 ⑥消去反应 ⑦加聚反应 ⑧缩聚反应等反应类型中,能体现这一原子最经济原则的是( )
A.①②⑤ B.②⑤⑦
C.⑦⑧ D.⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
茉莉醛具有浓郁的茉莉花香,其结构简式如下所示: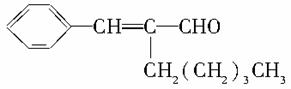 关于茉莉醛的下列叙述错误的是( )
关于茉莉醛的下列叙述错误的是( )
A.在加热、加压和催化剂作用下,能被氢气还原
B.能被高锰酸钾酸性溶液氧化
C.在一定条件下能与溴发生取代反应
D.不能与氢溴酸发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。
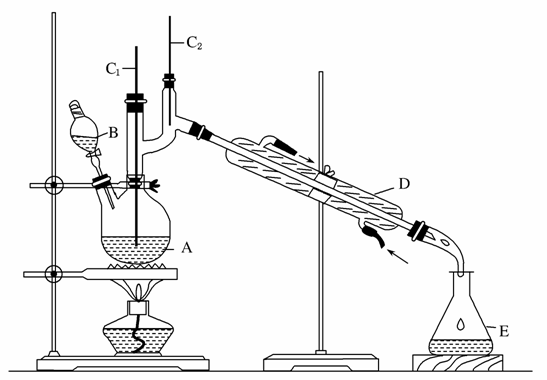
发生的反应如下:
CH3CH2CH2CH2OH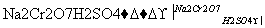 CH3CH2CH2CHO
CH3CH2CH2CHO
反应物和产物的相关数据列表如下:
| 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
| 正丁醇 | 11.72 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:
将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,再缓慢加入5 mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量2.0 g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由______
_______________________________________________。
(2)加入沸石的作用是________。若加热后发现未加沸石,应采取的正确方法是____________________________________________。
(3)上述装置图中,B仪器的名称是________,D仪器的名称是________。
(4)分液漏斗使用前必须进行的操作是________(填正确答案标号)。
a.润湿 b.干燥
C.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在________层(填“上”或“下”)。
(6)反应温度应保持在90~95 ℃,其原因是_________________。
(7)本实验中,正丁醛的产率为________%。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据酸碱质子理论,下列物质为酸碱两性物质的有( )
①H2SO4 ②NaHSO3 ③NaOH ④Na2CO3 ⑤NH4H2PO4 ⑥CH3COOH
A.①②⑤⑥ B.③④⑤
C.①②⑥ D.②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
我国化学家侯德榜(如图)改革国外的纯碱生产工艺,生产流程可简要表示如下:
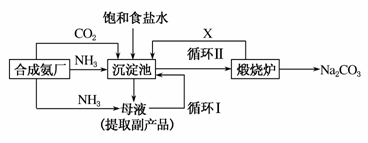

(1)上述生产纯碱的方法称________,副产品的一种用途为________。
(2)沉淀池中发生的化学反应方程式是________________________________________________________。
(3)写出上述流程中X物质的分子式________。
(4)使原料氯化钠的利用率从70%提高到90%以上,主要是设计了________(填上述流程中的编号)的循环,从沉淀池中取出沉淀的操作是________________________________。
(5)为检验产品碳酸钠中是否含有氯化钠,可取少量试样溶于水后,再滴____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上冶炼金属钼的化学原理为:
①2MoS2+7O2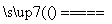 2MoO3+4SO2;
2MoO3+4SO2;
②MoO3+2NH3·H2O = (NH4)2MoO4+H2O;
③(NH4)2MoO4+2HCl = H2MoO4↓+2NH4Cl;
④H2MoO4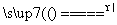 MoO3+H2O;
MoO3+H2O;
⑤用还原剂将MoO3还原成金属钼。则下列说法正确的是
A.上述①③⑤属于氧化还原反应,②④属于非氧化还原反应
B.MoO3是金属氧化物,也是碱性氧化物
C.H2MoO4是一种强酸
D.利用H2、CO和Al分别还原等量的MoO3,所消耗还原剂的物质的量之比为3∶3∶2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com