
【题目】某化学课外小组用如图所示装a制取溴苯并探究该反应的类型。先向分液漏斗中加人苯和液溴,再将混合液滴入反应器A(A下端活塞关闭)中。
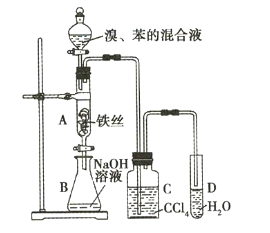
(1)反应结束后,打开A下端的活塞,让反应液流入B中,充分振荡,目的是___。
(2)C中盛放CCl4的作用是___。
(3)若要证明苯和液溴发生的是取代反应,而不是加成反应,通常有两种方法,请按要求填写下表。
向试管D中加入的试剂 | 能证明苯与液溴发生取代反应的现象 | |
方法一 | ___ | ___ |
方法二 | ___ | ___ |
【答案】除去溶于溴苯中的溴 除去溴化氢气体中的溴蒸气 AgNO3溶液 产生(淡黄色)沉淀 紫色石蕊试液 溶液变红色
【解析】
(1)有未反应的溴,导致所得溴苯不纯净;
(2)由于反应放热,苯和液溴均易挥发,溴的存在干扰检验H+和Br-;
(3) 溴化氫易溶于水电离出H+和Br-,通过检验H+和Br-证明。
(1)有未反应的溴,导致所得溴苯不纯净,不便于观察溴苯的颜色,氢氧化钠与溴反应除去溴,Br2+2NaOH=NaBr+NaBrO+H2O;
(2)由于反应放热,苯和液溴均易挥发,溴极易溶于四氯化碳,除去溴化氢气体中的溴蒸气,以防干扰检验H+和Br-;
(3)如果发生取代反应,生成溴化氢,溴化氫易溶于水电离出H+和Br-,只要检验含有氢离子或溴离子即可,溴离子的检验:取溶液滴加硝酸银溶液,如果生成淡黄色沉淀就证明是溴离子;氢离子的检验:如果能使紫色石蕊试液变红,就证明含有氢离子。


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.一定温度下,10mL 0.50mol·L-1 NH4Cl溶液与20mL 0.25mol·L-1 NH4C1溶液含NH4+物质的量相同
B.25℃时,将a mo1·L-l氨水与0.01 moI·L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(C1-),用含a的代数式表示反应完全时NH3·H2O的电离常数![]()
C.一定温度下,已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+,加少量烧碱溶液可使溶液中
CH3COO-+H+,加少量烧碱溶液可使溶液中![]() 值增大。
值增大。
D.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
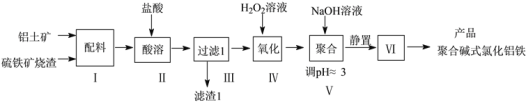
(1)步骤Ⅱ酸溶时,Fe2O3被溶解的化学程式为____,滤渣1的成分为____(填化学式)。
(2)步骤Ⅳ发生反应的离子方程式为________________。
(3)步骤V若将溶液pH调成6,可能造成的影响是_______;步骤Ⅵ包含的操作有_______。
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Al)/n(Fe)的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350 g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中n(Al)/n(Fe)的比值(写出计算过程)。__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高炉炼铁中常见的反应为![]()
![]() 某实验小组在实验室模拟上述反应。一定温度下,在
某实验小组在实验室模拟上述反应。一定温度下,在![]() 盛有
盛有![]() 粉末的恒容密闭容器中通入
粉末的恒容密闭容器中通入![]() ,5min时生成
,5min时生成![]() 内用CO表示的平均反应速率是______
内用CO表示的平均反应速率是______![]() ;5min时CO的转化率为______;若将此时反应体系中的混合气体通入
;5min时CO的转化率为______;若将此时反应体系中的混合气体通入![]() 的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______。
的NaOH溶液中,所得溶液中离子浓度由大到小的顺序是______。
![]() 上述反应的平衡常数表达式
上述反应的平衡常数表达式![]() ______;判断该反应已经达到平衡状态的依据是______
______;判断该反应已经达到平衡状态的依据是______![]() 填序号
填序号![]() 。
。
![]() 容器内固体质量保持不变
容器内固体质量保持不变 ![]() 容器中气体压强保持不变
容器中气体压强保持不变
![]()
![]()
![]() 已知上述反应的平衡常数K与温度
已知上述反应的平衡常数K与温度![]() 单位:
单位:![]() 之间的关系如图所示。
之间的关系如图所示。

根据图象可知,该反应的平衡常随温度升高而______![]() 填“增大”“减小”或“不变
填“增大”“减小”或“不变![]() 。
。
![]() 结合上述有关信息,指出两条提高CO的平衡转化率的措施:______
结合上述有关信息,指出两条提高CO的平衡转化率的措施:______![]() 写两条
写两条![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于如图所示的分子,下列叙述正确的是( )
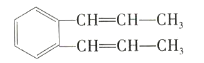
A.除苯环外的其余碳原子有可能在一条直线上
B.1mol该物质与足量溴水反应,最多消耗5molBr2
C.1mol该物质完全燃烧消耗16molO2
D.该分子最多有22个原子在同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将煤直接作为燃料燃烧,不但热效率较低,且产生烟尘、二氧化硫、氮氧化物等物质,造成严重的环境污染。煤的干馏是提高煤的利用率、生产重要化工原料、绣像污染物排放量的有效措施之一。某化学学习小组在实验室条件下探究煤干馏的现象及产物,装置如图所示,请回答有关问题:
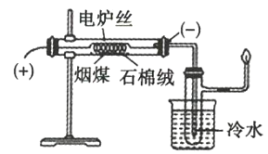
(1)煤干馏的条件是___。
(2)盛有冷水的烧杯的作用是___。
(3)实验后检验有粗氨水生成的操作是___。
(4)已知CO不能使溴水退色,若将从具支试管支管口处逸出的气体通入溴水中,发现溴水退色,则说明煤的干馏产生了___。
(5)从煤焦油中分离出苯、甲苯、二甲苯的实验方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不当的是
A.实验室制取少量蒸馏水时,不需要使用温度计
B.实验室制取少量的![]() 时,为防止其被氧化,应将吸NaOH溶液的胶头滴管插入
时,为防止其被氧化,应将吸NaOH溶液的胶头滴管插入![]() 溶液中
溶液中
C.防止浓![]() 在光照条件下变色,应将浓
在光照条件下变色,应将浓![]() 保存在棕色试剂瓶中
保存在棕色试剂瓶中
D.通常酒精灯中加入酒精的体积不超过酒精灯容积的三分之一
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用右图所示装置进行下列实验,能得出相应实验结论的是( )
选项 | ① | ② | ③ | 实验结论 | 实验装置 |
A | 稀硫酸 | Na2S | AgNO3与AgCl的溶液 | Ksp(AgCl)>Ksp(Ag2S) |
|
B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
C | 稀盐酸 | Na2SO3 | Ba(NO3)2 溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实能用勒夏特列原理来解释的是( )
A.SO2氧化SO3,往往需要使用催化剂2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
B.500 ℃左右的温度比室温更有利于合成氮反应N2(g)+ 3H2 (g)![]() 2NH3(g) △H<0
2NH3(g) △H<0
C.H2、I2、HI平衡混合气体加压后颜色加深H2(g)+ I2(g)![]() 2HI(g)
2HI(g)
D.实验室采用排饱和食盐水的方法收集氯气Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com