
【题目】一定温度下,在 5 L 的恒容密闭容器中发生反应N2(g)+3H2(g)2NH3(g)。反应过程中的部分数据如下表所示:
n/mol t/min | N(N2) | N(H2) | N(NH3) |
0 | a | 24 | 0 |
5 | 13 | 6 | |
10 | 12 | ||
15 | 8 |
下列说法正确的是
A.N2 的初始浓度为16 mol·L1
B.0~5 min 用H2表示的平均反应速率为0.24 mol·L1·min1
C.平衡状态时,c(N2)=2.6 mol·L1
D.N2 的平衡转化率为 25%
 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】下列关于2—环己基丙烯(![]() )和2—苯基丙烯(
)和2—苯基丙烯(![]() )的说法中正确的是( )
)的说法中正确的是( )
A.二者均可使溴水、高锰酸钾褪色,且褪色原理相同
B.2—苯基丙烯分子中所有碳原子一定共平面
C.二者可与足量的氢气在一定条件下反应得到同一种产物,此产物的一氯代物有5种
D.二者可以通过加成聚合反应形成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的NaHCO3分为三等份,第一份直接加入盐酸中,消耗盐酸物质的量为n1,第二份首先加热,使其完全分解后,再加入盐酸中,消耗盐酸物质的量为n2,第三份首先加热,使其部分分解后,再加入盐酸中,消耗盐酸物质的量为n3,假若与盐酸都完全反应,则n1、n2、n3的大小关系正确的是( )
A. n1=n2=n3 B. n2>n1>n3 C. n1>n2>n3 D. n1>n3>n2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,磷酸二氢钾(KH2PO4)大晶体已应用于我国研制的巨型激光器“神光二号”中。 某兴趣小组制备 KH2PO4,流程如下:
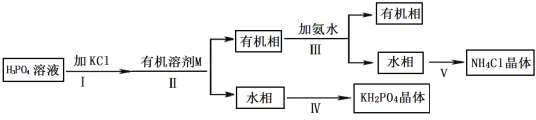
已知:
a.KH2PO4 有潮解性,溶于水,不溶于乙醇和醚等有机溶剂。
b.HCl 易溶于乙醇和醚等有机溶剂。
请回答:
(1)步骤Ⅱ的实验操作是_____。
(2)有关步骤Ⅲ,下列说法正确的是_____。
A.有机溶剂 M 可用乙醇
B.步骤Ⅲ与步骤Ⅱ的实验操作基本相同
C.NH4Cl 在水中溶解度明显大于在有机溶剂 M 中
D.有机溶剂 M 可循环使用
(3)试从平衡角度分析,由步骤Ⅰ、Ⅱ得到 KH2PO4 溶液的原理:_____。
(4)在下列仪器中,使用前需进行“检漏”操作的是_____。
A.吸滤瓶 B.球型分液漏斗 C.蒸馏烧瓶 D.碱式滴定管
(5)步骤Ⅳ,包括蒸发浓缩、冷却结晶、过滤、干燥等多步操作。在冷却结晶操作中,为了得到 磷酸二氢钾大晶体,常采取的措施有____________________。某同学发现使用加热浓缩、冷却结晶得到的磷酸二氢钾晶体欠佳,请提出针对性的改进实验方案:_____________,然后经过滤、干燥得到晶体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以碘为原料,通过电解制备 KIO3 的实验装置如右图所示。电解前,先将一定量的精制碘溶于过 量 KOH 溶液,溶解时发生反应:3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入某电极区。将 KOH 溶液加入另一电极区,电解槽用水冷却。下列说法不正确的是
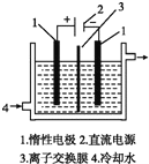
A.产品 KIO3 在阳极区得到B.离子交换膜为阴离子交换膜
C.电解时,须不断补充 KOHD.阴极区加入的是 KOH 溶液,发生还原反应生成 H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以含银废液{主要含[Ag(NH3)2]+、[Ag(S2O3)2]3-}为原料制取硝酸银晶体,其实验流程如下:
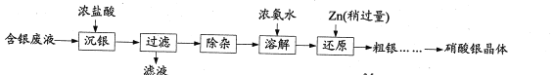
已知:①“沉银”所得AgCl中含有少量PbCl2、Ag2S。
②Zn2+在浓氨水中以[Zn(NH3)4]2+形式存在。
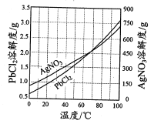
③PbCl2、AgNO3的溶解度曲线如图所示:
(1)“滤液”中的主要阳离子为___(填化学式)。
(2)“除杂”分为两步:先除去PbCl2,再除去Ag2S。
①在不同温度下,AgCl、Ag2S均难溶于水。 除去PbCl2的操作为______,热水洗涤。
②向热水洗涤所得固体中加入浓硝酸和稀盐酸,边加热边充分搅拌,使Ag2S转变为AgCl。加入浓硝酸的目的是_______。
(3)室温下,可逆反应AgCl+2NH3·H2O[Ag(NH3)2]++Cl-+2H2O的平衡常数K=___。{Ksp(AgCl)= 1.8×10-10,Ag++2NH3·H2O[Ag(NH3)2]++2H2O的平衡常数为1.1×107}
(4)“还原”过程中发生反应的离子方程式为_____ 。
(5)粗银经水洗后,经多步处理可制备硝酸银晶体。请补充完整由以水洗后粗银为原料,制备硝酸银晶体的实验方案:________,过滤,________,将产生的气体和空气混合后通入NaOH溶液进行尾气处理,将所得AgNO3溶液_______,过滤,将所得晶体置于烘箱 (120℃)干燥,密封包装。(实验中须使用的试剂:稀硫酸、稀硝酸、BaC12溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是( )
![]()
A.金属性:甲>乙>丁
B.原子半径:辛>己>戊
C.丙与庚的原子核外电子数相差3
D.乙的单质在空气中燃烧生成只含离子键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D四种短周期元素,A分别与B、C、D结合生成甲、乙、丙三种化合物,且甲、乙、丙三分子中含相同数目的质子数,C、D结合生成化合物丁。有关元素的单质和甲、乙、丙、丁四种化合物的转化关系如下图所示:

(1)写出B+乙―→甲+C的化学反应方程式___________________________
(2)根据以上条件可以确定A、B、C、D四种元素中的三种,不能被确定的第四种元素是________。(填写序号) ①A ②B ③C ④D
(3)依据下列条件可以进一步确定上述第四种元素:①甲与丙以及乙与丙均能够发生反应,②甲、丙都是无色、有刺激性气味的物质。
据此,请回答下列问题:写出上述第四种元素在周期表中第_______周期第_______族;写出C+丙―→乙+丁的化学反应方程式_________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是可逆反应2A+3B![]() C+2D的化学反应速率与化学平衡随外界条件改变而变化的情况,由此可推断( )
C+2D的化学反应速率与化学平衡随外界条件改变而变化的情况,由此可推断( )

A.正反应是放热反应
B.逆反应是吸热反应
C.若C、D是气体,则B是液体或固体
D.A、B、C、D均为气体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com