
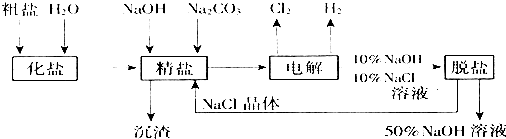
分析 (1)电解氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极附近生成氢氧化钠;
(2)除杂注意不能引入新的杂质,有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(3)若氯气和氢氧化钠充分接触,产物仅是次氯酸钠和氢气,则发生的反应为 NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(4)电解池中,活泼金属作阳极时电极材料失电子变成离子进入溶液,根据溶液中阳离子的放电顺序判断阴极上发生的电极反应,据此书写产生大量的红棕色沉淀的方程式.
解答 解:(1)电解食盐水,与正极相连为阳极,生成氯气,该电极反应为2Cl--2e-═Cl2↑,与电源负极相连为阴极,生成氢气和NaOH,生成碱,所以pH升高,
故答案为:2Cl--2e-═Cl2↑;升高;
(2)镁离子用氢氧根离子沉淀,加入过量的氢氧化钠可以将镁离子沉淀,硫酸根离子用钡离子沉淀,加入过量的氯化钡可以将硫酸根离子沉淀,至于先除镁离子,还是先除硫酸根离子都行,钙离子用碳酸根离子沉淀,除钙离子加入碳酸钠转化为沉淀,但是加入的碳酸钠要放在加入的氯化钡之后,这样碳酸钠会除去反应剩余的氯化钡,杂质离子都沉淀了,再进行过滤,最后再加入盐酸除去反应剩余的氢氧根离子和碳酸根离子,所以正确的顺序为:加过量的BaCl2溶液,加过量的Na2CO3溶液,加过量的NaOH溶液,过滤,加适量的盐酸;或者,加过量的NaOH溶液,加过量的BaCl2溶液,加过量的Na2CO3溶液,过滤,滤液加适量的盐酸,
故答案为:加过量的BaCl2溶液,加过量的Na2CO3溶液,加过量的NaOH溶液,过滤,加适量的盐酸;或者,加过量的NaOH溶液,加过量的BaCl2溶液,加过量的Na2CO3溶液,过滤,滤液加适量的盐酸;
(3)采用无隔膜电解冷的食盐水时,2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+NaOH、若氯气和氢氧化钠充分接触,Cl2+2NaOH=NaCl+NaClO+H2O,产物仅是次氯酸钠和氢气,则发生的总反应为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑,
故答案为:NaCl+H2O$\frac{\underline{\;电解\;}}{\;}$NaClO+H2↑;
(4)电解池中,活泼金属作阳极时电极材料失电子变成离子进入溶液,用石墨电极作阴极,铁电极作阳极电解水时,阳极电极反应式为:Fe-2e-=Fe2+;阴极上得电子反应还原反应,电极反应式为:2H2O+2e-=H2↑+2OH-,二价铁离子和氢氧根离子能发生反应生成白色的氢氧化亚铁沉淀,白色的氢氧化亚铁沉淀不稳定,能迅速变为灰绿色,氢氧化亚铁和氧气能发生氧化还原反应生成红褐色氢氧化铁沉淀,反应方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,所以反应为:Fe-2e-=Fe2+、2H2O+2e-=H2↑+2OH-、Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3,
故答案为:阳极:Fe-2e-=Fe2+、阴极:2H2O+2e-=H2↑+2OH-;Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
点评 本题考查粗盐提纯及电解原理,明确发生的离子反应及电解反应是解答的关键,注意除杂不能引入新的杂质及试剂的添加顺序,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 金属铝能够在空气中稳定存在是因为其在常温下不与氧气反应 | |
| B. | 氧化铝与NaOH溶液的反应体现了氧化铝的酸性氧化物的特性 | |
| C. | 明矾的水溶液具有“净水、杀菌消毒”的作用 | |
| D. | 氢氧化铝是两性氢氧化物,其“两性”是指既具有氧化性,又具有还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电池的电解液为碱性溶液,正极为Ni 2O 3、负极为Fe | |
| B. | 电池放电时,负极反应为Fe+2OH --2e -═Fe(OH) 2 | |
| C. | 电池充电过程中,阴极附近溶液的pH降低 | |
| D. | 电池充电时,阳极反应为2Ni(OH) 2+2OH --2e -═Ni 2O 3+3H 2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠在氧气中燃烧,火焰呈黄色,产生白色固体 | |
| B. | 屠呦呦女士利用乙醇萃取青蒿汁中的青蒿素,获得了2015年度诺贝尔生理学或医学奖,为人类防治疟疾作出了重大贡献 | |
| C. | 红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟 | |
| D. | 钠投入水中,将沉在水底并熔化成小球,且有气泡产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 家庭消毒时,消毒液越浓越好 | |
| B. | 烹饪时用“加碘食盐”可预防“非典” | |
| C. | 应经常保持室内清洁卫生和通风 | |
| D. | 必须每天吃药,补充人体所需化学物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物质在不电离的条件下,也能导电 | |
| B. | 若化学平衡向逆反应方向移动,则正反应速率不一定减小 | |
| C. | 硫酸钡、醋酸铵、碳酸氢钠都是强电解质 | |
| D. | 导电性强的溶液里自由移动离子数目一定比导电性弱的溶液里自由移动离子数目多 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:NaHCO3<Na2CO3 | |
| B. | 与同浓度盐酸反应的剧烈程度:NaHCO3<Na2CO3 | |
| C. | 相同温度时,在水中的溶解性:NaHCO3<Na2CO3 | |
| D. | 等物质的量浓度溶液的碱性:NaHCO3<Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 | B. | 5 | C. | 6 | D. | 7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com