
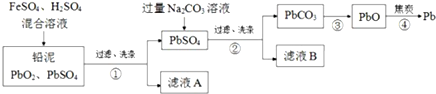
分析 向铅泥(主要成分PbO2、PbSO4)中加入硫酸亚铁和硫酸,二氧化铅中+4价的铅与亚铁离子发生氧化还原反应,生成难溶物硫酸铅,过滤得到硫酸铅和滤液A(含三价铁离子),硫酸铅与碳酸钠反应,沉淀转化为碳酸铅,同时产生硫酸钠,过滤得到碳酸铅,碳酸铅分解得到氧化铅,再用焦炭还原得到金属铅,据此分析解答.
(1)步骤①为提高反应速率可以采用升高温度、充分搅拌等方法;二氧化铅与亚铁离子在硫酸的作用下发生氧化还原反应生成三价铁和硫酸铅;
(2)滤液B的溶质为硫酸钠,提取含结晶水的硫酸盐(摩尔质量为322g/mol),硫酸钠的摩尔质量为142g/mol,据此计算结晶水的个数;主要实验步骤为:向该滤液中加入适量的硫酸钠增大浓度,然后蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到产品;
(3)根据盖斯定律计算PbO与焦炭反应生成Pb和CO2的反应热,再写出热化学反应方程式;
(4)第③步碳酸铅分解产生的二氧化碳的物质的量与铅原子物质的量相等,第④步产生的二氧化碳和一氧化碳中的氧全部来至于氧化铅,根据氧原子守恒建立氧原子与铅的关系式可解出铅的物质的量,即硫酸铅的物质的量,铅泥中的硫酸铅不包括第①步反应产生的硫酸铅.
解答 解:向铅泥(主要成分PbO2、PbSO4)中加入硫酸亚铁和硫酸,二氧化铅中+4价的铅与亚铁离子发生氧化还原反应,生成难溶物硫酸铅,过滤得到硫酸铅和滤液A(含三价铁离子),硫酸铅与碳酸钠反应,沉淀转化为碳酸铅,同时产生硫酸钠,过滤得到碳酸铅,碳酸铅分解得到氧化铅,再用焦炭还原得到金属铅.
(1)步骤①为提高反应速率可以采用升高温度、充分搅拌等方法;二氧化铅与亚铁离子在硫酸的作用下发生氧化还原反应生成三价铁和硫酸铅,离子反应方程式为:PbO2+4H++SO42-+2Fe2+=2Fe3++PbSO4↓+2H2O,
故答案为:充分搅拌或适当升高温度;PbO2+4H++SO42-+2Fe2+=2Fe3++PbSO4↓+2H2O;
(2)滤液B的溶质为硫酸钠,提取含结晶水的硫酸盐(摩尔质量为322g/mol),硫酸钠的摩尔质量为142g/mol,则结晶水的个数为:(322-142)÷18=10,则该结晶水合物的化学式为Na2SO4•10H2O;主要实验步骤为:向该滤液中加入适量的硫酸钠增大浓度,然后蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到产品,
故答案为:Na2SO4•10H2O;硫酸钠;冷却结晶;
(3)①PbO(s)+C(s)═Pb(s)+CO(g)△H=+108.5kJ/mol
②2Pb(s)+O2(g)═2PbO(s)△H=-438kJ/mol
③2CO(g)+O2(g)═2CO2(g)△H=-565kJ/mol
根据盖斯定律(①×2+③-②)÷2得到PbO与焦炭反应生成Pb和CO2的热化学方程式是:2PbO(s)+C(s)═2Pb(s)+CO2(g)△H=+45KJ/mol,
故答案为:2PbO(s)+C(s)═2Pb(s)+CO2(g)△H=+45KJ/mol;
(4)步骤③、④中共收集到11.2LCO2,物质的量为0.5mol,设第③步产生的二氧化碳为xmol,第③步碳酸铅分解产生的二氧化碳的物质的量与铅原子物质的量相等,第④步产生的二氧化碳为ymol,则有:x+y=0.5①,步骤④中还收集到4.48LCO,物质的量为0.2mol,第④步产生的二氧化碳和一氧化碳中的氧全部来至于氧化铅,根据氧原子守恒建立氧原子与铅的关系式为0.2x+2y=x②,根据①②式解得x=0.4,则所有的硫酸铅的物质的量为0.4mol,铅泥中的硫酸铅不包括第①步反应产生的硫酸铅,第①步产生的硫酸铅与硫酸亚铁的关系为:2FeSO4~PbSO4,硫酸亚铁反应0.2mol,硫酸铅生成0.1mol,则铅泥中的硫酸铅为0.3mol,硫酸铅的摩尔质量为303g/mol,则铅泥中硫酸铅的质量为:0.3mol×303g/mol=90.9g,
故答案为:90.9.
点评 本题考查较综合,涉及混合物的分离和提纯、氧化还原反应、定量计算等知识点,试题有利于提高学生的分析、理解能力及化学实验能力,第(4)题有一定难度.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | HCl的电子式: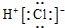 | B. | CO2分子的结构式:O=C=O | ||
| C. | Na的原子结构示意图: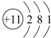 | D. | 钙离子的电子式:Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2=CH2+HCl $→_{△}^{催化剂}$ CH3CH2Cl | |
| B. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| C. | nCH2=CH2$→_{加热、加压}^{催化剂}$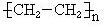 | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaO | B. | CO | C. | SiO2 | D. | H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
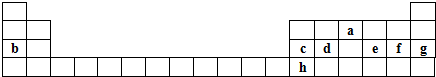
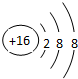 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Z与X形成化合物的沸点高于Z的同族元素与X形成化合物的沸点 | |
| B. | 原子半径:Z>Y>X | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaY2和CaZ22种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com