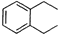
某溶液中可能含有K
+、NH
4+、Al
3+、AlO
2-、SO
42-、SiO
32-、CO
32-、Cl
-、OH
-中的某几种离子,甲,乙两同学共同进行如下实验:
①取少量溶液加入用足量硝酸酸化的Ba(NO
3)
2溶液,有气泡产生同时有白色沉淀生成.
②将①过滤得到的白色沉淀洗涤再分成两份,一份加盐酸沉淀不溶解.另一份加NaOH溶液发现沉淀能完全溶解.
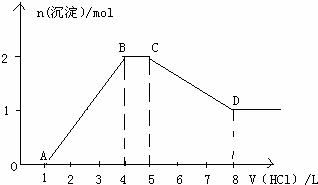
③另取0.5L溶液慢慢滴加入某浓度盐酸,其产生沉淀物质的量和所加盐酸体积关系如图所示.
(1)根据以上实验,原溶液中一定存在的离子是
,将一定存在的阴离子及物质的量浓度填表(可不填满也可补充)
(2)原溶液中可能存在的离子是
.
为了检验该离子是否存在你的设计的方案是:
.
(3)所用盐酸的物质的量浓度是:
.
(4)甲、乙两同学分析溶液加盐酸产生沉淀情况得出A-B生成沉淀为两种,到底哪种离子先和盐酸反应生成沉淀争执不下,他们查阅有关资料:H
2CO
3的电离常数:K
1=4.3×10
-7,K
2=5.6×10
-11,H
2SiO
3的电离常数:K
1=1.7×10
-10,K
2=1.6×10
-12,HAlO
2的电离常数:K=6.3×10
-13,Al(OH)
3的电离常数:K
b1=1.4×10
-9,
根据③中实验结合资料按照反应顺序逐步书写出③中发生反应的离子方程式:
O→A:
.
A→B:
.
B→C:
.
C→D:
.




 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
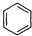 +2H2C=CH2
+2H2C=CH2
 +2H2C=CH2
+2H2C=CH2