
| A、2:7 | B、1:7 |
| C、8:7 | D、1:1 |
| 1 |
| 2 |


科目:高中化学 来源: 题型:
A、钠在氧气中燃烧,钠的氧化产物: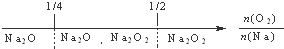 |
B、铁在Cl2中燃烧,铁的氧化产物: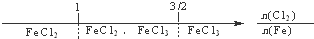 |
C、NH3与Cl2反应,反应产物: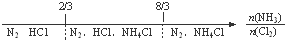 |
D、FeBr2溶液中通入Cl2,铁元素存在形式: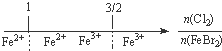 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、70℃,将0.1 mol 镁粉加入到10 mL 6 mol?L-1 的硝酸溶液中 |
| B、60℃,将0.2 mol 镁粉加入到20 mL 3 mol?L-1 的盐酸溶液中 |
| C、60℃,将0.1 mol 镁粉加入到10 mL 3 mol?L-1 的硫酸溶液中 |
| D、60℃,将0.2 mol 铁粉加入到10 mL 3 mol?L-1 的盐酸溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在饱和氯化铁溶液中滴加NaOH溶液,产生红褐色沉淀 |
| B、使用微波手术刀进行外科手术,可使开刀处的血液迅速凝固而减少失血 |
| C、清晨,在茂密的树林中,常常可以看到枝叶间透过的一道道光线 |
| D、肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、物质的量相等的水与重水含有的中子数 |
| B、等质量的氧气和臭氧中含有的氧原子数 |
| C、同温、同压、同体积的一氧化碳和乙烯含有的质子数 |
| D、等物质的量的钠和铜分别与氧气完全反应,转移的电子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl2+2Br-═2Cl-+Br2 |
| B、2Fe2++Cl2═2Fe3++2Cl- |
| C、2Fe2++2Br-+2Cl2═2Fe3++4Cl-+Br2 |
| D、2Fe2++4Br-+3Cl2═2Fe3++6Cl-+2Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Br2+2I-=I2+2 Br- |
| B、2FeCl2+Cl2=2FeCl3 |
| C、2FeCl2+2HCl+I2=2FeCl3+2HI |
| D、2Fe3++2I-=2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
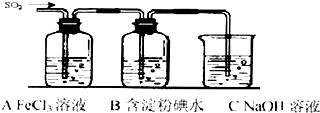
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com