
| A. | 在一定温度下的BaSO4水溶液中,Ba2+和SO42-浓度的乘积是一个常数 | |
| B. | 向含有BaSO4固体的溶液中加入适量的水使溶解又达到平衡时,BaSO4的溶度积不变,其溶解度也不变 | |
| C. | 只有难溶电解质才存在沉淀溶解平衡过程 | |
| D. | 向饱和的BaSO4水溶液中加入硫酸,BaSO4的Ksp变大 |
分析 A.一定温度下,硫酸钡的溶度积常数是定值,但Ba2+和SO42-浓度的乘积不是定值;
B.溶度积常数、溶解度都与温度有关;
C.任何电解质都存在沉淀溶解平衡;
D.溶度积常数只与温度有关.
解答 解:A.一定温度下,硫酸钡的溶度积常数是定值,但Ba2+和SO42-浓度的乘积不是定值,可能等于或小于溶度积常数,故A错误;
B.溶度积常数、溶解度都与温度有关,温度不变溶度积常数及溶解度都不变,所以向含有BaSO4固体的溶液中加入适量的水使溶解又达到平衡时,温度不变,则BaSO4的溶度积不变、其溶解度也不变,故B正确;
C.任何电解质都存在沉淀溶解平衡,只要电解质在溶液中溶解的速率等于结晶的速率就达到了沉淀溶解平衡状态,故C错误;
D.溶度积常数只与温度有关,向饱和的BaSO4水溶液中加入硫酸,硫酸根离子浓度增大抑制硫酸钡溶解,温度不变则BaSO4的Ksp不变,故D错误;
故选B.
点评 本题考查溶度积常数影响因素,化学平衡常数、电离平衡常数、盐类水解平衡常数、溶度积常数等都只与温度有关,与物质浓度无关,易错选项是AC.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 升高温度,可以加快反应速率 | |
| B. | 使用催化剂是为了加快反应速率 | |
| C. | 在上述条件下,SO2不能完全转化为SO3 | |
| D. | 达到平衡时,SO2的浓度与SO3的浓度一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
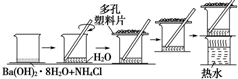 研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:
研究化学反应中的能量变化时,在一只小烧杯里,加入20g已研磨成粉末的Ba(OH)2•8H2O,将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯中加入约10g NH4Cl晶体,根据下图所示实验步骤进行操作.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
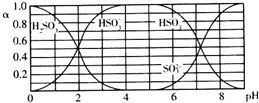
| A. | 溶液的pH=5时,硫元素的主要存在形式为HSO3- | |
| B. | 当溶液恰好呈中性时:c(Na+)>c(SO32-)+c(HSO3-) | |
| C. | 向pH=8的上述溶液中滴加少量澄清石灰水,$\frac{{c({HSO_3^-})}}{{c({SO_3^{2-}})}}$的值增大 | |
| D. | 向pH=3的上述溶液中滴加少量稀硫酸,α(HSO3-)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
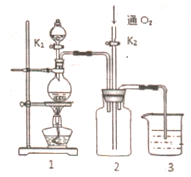 硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)
硫酸铜是一种应用极其广泛的化工原料,铜不能与稀硫酸直接反应,本实验中将适量浓硝酸分多次加入到铜粉与稀硫酸的混合物中,加热使之反应完全,通过蒸发、结晶得到硫酸铜晶体(装置如图1、2所示)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
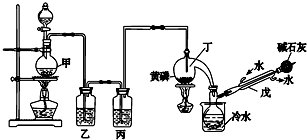
| 熔点/℃ | 沸点/℃ | 其他 | |
| 黄磷 | 44.1 | 280.5 | 2P(过量)+3Cl2$\frac{\underline{\;\;△\;\;}}{\;}$2PCl3;2P+5Cl2(过量)$\frac{\underline{\;\;△\;\;}}{\;}$2PCl5 |
| PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
| POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | n-5 | B. | n+3 | C. | n+13 | D. | n-13 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com