
下列说法正确的是
A.棉、麻、羊毛及合成纤维完全燃烧都只生成CO2和H2O
B.蛋白质是结构复杂的高分子化合物,分子中都含有C、H、O、N四种元素
C.用KMnO4酸性溶液鉴别CH3CH=CHCH2OH和CH3CH2CH2CHO
D.向盛有少量苯酚稀溶液试管中滴加少量稀溴水,边滴边振荡,有白色沉淀出现
科目:高中化学 来源:2013-2014天津市南开区高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
(14分)已知X、Y、Z、M、G、Q是六种短周期元素,原子序数依次增大。X、Z、Q的单质在常温下呈气态;Y的原子最外层电子数是其电子层数的2倍;X与M同主族;Z、G分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)Y、Z、M、G四种元素原子半径由大到小的顺序是(写元素符号) 。
(2)Z在元素周期表中的位置为 。
(3)上述元素的最高价氧化物对应的水化物酸性最强的是(写化学式) 。
(4)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式) ,在实验室中,制取该物质的反应原理是(写化学方程式) 。
(5)M2Z的电子式为 。MX与水反应可放出气体,该反应的化学方程式为 。
(6)常温下,不能与G的单质发生反应的是(填序号) 。
a.CuSO4溶液 b.Fe2O3 c.浓硫酸 d.NaOH溶液 e.Na2CO3固体
工业上用电解法制G的单质的化学方程式是 ,若以石墨为电极,阳极产生的混合气体的成分是(写化学式) 。
查看答案和解析>>
科目:高中化学 来源:2013-2014天津市东丽区第一学期期末质量监测高一年级化学试卷(解析版) 题型:选择题
下列化学方程式中,不能用H++OH-=H2O表示的是
A.KOH+HCl=KCl+H2O B.2NaOH+H2SO4=Na2SO4+2H2O
C.Ba(OH)2+2HCl=BaCl2+2H2O D.Cu(OH)2+2HNO3=Cu(NO3)2+2H2O
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高二下学期期末考试化学试卷(解析版) 题型:选择题
脑白金主要成分的结构简式如图所示,下列对脑白金主要成分的推论肯定正确的是
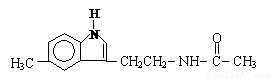
A.该分子含有一个肽键,属于二肽
B.该物质能发生水解反应
C.该物质不能与溴水反应
D.其官能团和营养成分与葡萄糖相同
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高二下学期期末考试化学试卷(解析版) 题型:选择题
下列关于有机化合物的认识不正确的是
A.盐析可提纯蛋白质并保持其生理活性
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.石油分馏可获得乙烯、丙烯和丁二烯
D.向澄清的苯酚钠溶液中通入二氧化碳气体,会看到澄清溶液变浑浊
查看答案和解析>>
科目:高中化学 来源:2013-2014天津五区县高一下学期期末考试化学试卷(解析版) 题型:选择题
某同学做完铜、锌稀硫酸原电池的实验后得出了下列结论,你认为正确的是
A.构成原电池正极和负极的材料必须是两种金属
B.当由铜、锌电极与硫酸铜溶液组成原电池时,铜是负极
C.该实验电子沿导线由锌流向铜,氢离子得到电子而放出氢气
D.铜锌原电池工作时,电流由锌经导线流向铜
查看答案和解析>>
科目:高中化学 来源:2013-2014四川绵阳中学实验学校高考冲刺理综化学试卷(解析版) 题型:实验题
(15分)雾霾含有大量的污染物SO2、NO。工业上变“废”为宝,吸收工业尾气SO2和NO,可获得Na2S2O3和NH4NO3产品的流程图如下(Ce为铈元素):
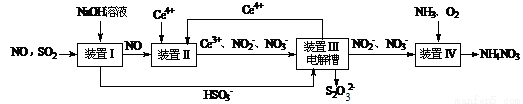
⑴装置Ⅰ中的主要离子方程式为 。3
⑵含硫各微粒(H2SO3、HSO3-和SO32-)存在于SO2与NaOH溶液反应后的溶液中,它们的物质的量分数X(i)与溶液pH 的关系如图所示。
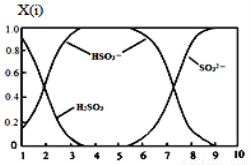

①若是0.1molNaOH反应后的溶液,测得溶液的pH=8时,溶液中个离子由大到小的顺序是 。
②向pH=5的NaHSO3溶液中滴加一定浓度的CaCl2溶液,溶液中出现浑浊,pH降为2,用化学平衡移动原理解释溶液pH降低的原因: 。
⑶写出装置Ⅱ中,酸性条件下的离子方程式 。
⑷装置Ⅲ还可以使Ce4+再生,其原理如下图所示。
①生成Ce4+从电解槽的 (填字母序号)口流出。②写出与阴极的反应式 。
⑸已知进入装置Ⅳ的溶液中,NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,需至少向装置Ⅳ中通入标准状况下的O2 L。(用含a代数式表示, 计算结果保留整数)
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省下学期期中考试高二化学试卷(解析版) 题型:选择题
如图是关于反应A2(g)+3B2(g)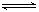 2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
2C(g)(正反应为放热反应)的平衡移动图象,影响平衡移动的原因可能是( )
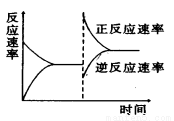
A.升高温度,同时加压 B.降低温度,同时减压
C.增大反应物浓度,同时减小生成物浓度 D.增大反应物浓度,同时使用催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com