
下列判断不正确的是
A.0.1mol/L的NaHA溶液其pH=4,则c(HA-)>c(H+)>c(H2A)>c(A2-)
B.pH=3的盐酸溶液和pH=11的氨水溶液等体积混合后溶液显碱性
C.pH=2的HA溶液与pH=12的MOH溶液任意比例混合后有:c(H+)+c(M+)=c(OH-)+c(A-)
D.物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后有:c(CH3COO-)+2c(OH-)=2c(H+)+c(CH3COOH)
A
解析试题分析:A、0.1mol/L的NaHA溶液其pH=4,显酸性,说明HA-的电离程度大于其水解程度,则有c(H2A) < c(A2-),错误;B、pH=3的盐酸溶液和pH=11的氨水溶液等体积混合,氨水远远过量溶液显碱性,正确;C、该项为混合液的电荷守恒式,正确;D、混合液中电荷守恒式为:c(CH3COO-)+c(OH-)=c(H+)+c(Na+),物料守恒式为:c(Na+)=1/2[c(CH3COOH)+c(CH3COO-)].把电荷守恒中的c(Na+)用元素守恒式代替,整理可得,正确。
考点:考查电解质溶液中 粒子浓度大小关系,强酸和弱酸的比较,溶液的酸碱性等考点的理解


科目:高中化学 来源: 题型:单选题
在稀CH3COOH溶液中存在如下电离平衡:CH3COOH CH3COO- + H+,下列叙述正确的是
CH3COO- + H+,下列叙述正确的是
| A.加入水时,平衡左移 | B.加入少量0.1mol/LHCl溶液,溶液中c(H+)减小 |
| C.加入少量NaOH固体,平衡右移 | D.加入少量CH3COONa固体,平衡右移 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于强、弱电解质的叙述,有错误的是( )
| A.强电解质在溶液中完全电离,不存在电离平衡 |
| B.在溶液中,导电能力强的电解质是强电解质,导电能力弱的电解质是弱电解质 |
| C.强电解质都是离子化合物,弱电解质都是共价化合物 |
| D.纯净的强电解质在液态时,有的导电,有的不导电 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列四种溶液中,室温下由水电离生成的H+浓度之比(①∶②∶③∶④)是( )
①pH=0的盐酸
②0.1 mol·L-1的盐酸
③0.01 mol·L-1的NaOH溶液
④pH=11的NaOH溶液
| A.1∶10∶100∶1 000 | B.0∶1∶12∶11 |
| C.14∶13∶12∶11 | D.14∶13∶2∶3 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
W、X、Y、Z四种元素均为短周期元素且原子序数依次增大,其简单离子都能促进水的电离的是
| A.W2-、X+ | B.X+、Y3+ | C.X+、Z2- | D.Y3+、Z2- |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在醋酸的电离过程中,加入水会使下列比值增大的是
| A.c(CH3COOH)/c(CH3COO—) | B.c(CH3COO—)/c(OH—) |
| C.c(H+)/c(CH3COOH) | D.c(H+)/ c(OH—) |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下amo1/L CH3COOH稀溶液和b mol/L KOH稀溶液等体积混合,下列判断一定错误的是
| A.c(OH一)>c(H+)时,a=b | B.c(K+)>c(CH3COO—)时,a>b |
| C.c(OH一)=c(H+)时,a>b | D.c(K+)<c(CH3COO—)时,a<b |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
某温度下,
 分别在溶液中达到沉淀溶解平衡后,改变溶液
分别在溶液中达到沉淀溶解平衡后,改变溶液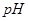 ,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
,金属阳离子浓度的变化如图所示。据图分析,下列判断错误的是
A. |
B.加适量 固体可使溶液由 固体可使溶液由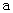 点变到 点变到 点 点 |
C.  两点代表的溶液中 两点代表的溶液中 与 与 乘积相等 乘积相等 |
D. 、 、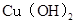 分别在 分别在 、 、 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com