
���� �ڱ���ʳ��ˮ�д���Na+��H+��OH-��Cl���ڵ����У�����������������������ǿ���������ȵõ����ӣ�������������������ԭ��ǿ��������������ʧ���ӣ���ⱥ��ʳ��ˮʱ�������ϵ缫��ӦʽΪ2Cl--2e-=Cl2���������ϵ缫��ӦʽΪ2H++2e-=H2�����������Ժ�ǿ��֮�䷴Ӧ�����Ȼ��ơ��������ƺ�ˮ����������������Һ����Ч�ɷ֣�
��� �⣺�ڱ���ʳ��ˮ�д���Na+��H+��OH-��Cl���ڵ����У�����������������������ǿ���������ȵõ����ӣ��缫��ӦʽΪ2H++2e-=H2����������������������ԭ��ǿ��������������ʧ���ӣ��缫��ӦʽΪ2Cl--2e-=Cl2������ⱥ��ʳ��ˮʱ�������ϵ缫��ӦʽΪ2Cl--2e-=Cl2�����������ų������������224mL��0.01mol������������״������ת�Ƶ���0.02mol������ʳ��0.02mol��������0.02mol��58.5g/mol=1.17g�����Դ�������������������õ缫��ӦʽΪ2H++2e-=H2�����缫������Һ��pHֵ�������������������ͨ��������������Һ����������Һ�У��������Ժ�ǿ����������֮�䷴Ӧ�����Ȼ��ơ��������ƺ�ˮ�����γɼ�������Һ����������������Һ����Ч�ɷ֣���ӦΪ��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��Na+��H+��OH-��Cl-��Na+��H+��OH-��Cl-��H+��Na+��H2��Cl-��OH-��Cl2��1.17��0.02�����Cl2+2NaOH=NaCl+NaClO+H2O��
���� ���⿼��ѧ�����صĹ���ԭ���Լ�������ǿ��֮��ķ�Ӧ֪ʶ�������ۺ�֪ʶ�Ŀ��飬�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
 ����ͼ��ʾװ�ý���ʵ�飨�г�װ������ȥ������ش��������⣺
����ͼ��ʾװ�ý���ʵ�飨�г�װ������ȥ������ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���շϾɵ�أ���ҪĿ���ǻ������еĹ���� | |
| B�� | ����ʯ��ʹ�ã����÷��ܡ�̫���ܡ�ȼú����Դ��������ɫ��ѧ������ | |
| C�� | ��ʳƷ���з���ʢ�й轺����С�����ɷ�ֹʳ���������� | |
| D�� | �ý��ݹ����������Һ�Ĺ���������ˮ���е���ϩ������ʵ��ˮ�����ʵ�Ŀ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��ѧʵ����ͻ�����Ч�ؼ�����Ⱦ��ʵ�ֻ�ѧʵ����ɫ����Ҫ��ijѧ�������в�����һ��ʵ�飺��һ���³İ�ֽ�IJ���Ƭ�IJ�ͬλ�÷ֱ�μ�Ũ��Ϊ0.1mol/L ��KBr��KI����������Һ����NaOH������̪����FeCl2����KSCN����Һ��1�Σ�ÿ��Һ�α˴˷ֿ���Χ�ɰ뾶С�ڱ������Բ�Σ���ͼ��ʾ������Բ�Ĵ�����2��֥������С��KMnO4���壬��KMnO4����μ�һ��Ũ���ᣬ��������������Ǻã�����֪��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O��
��ѧʵ����ͻ�����Ч�ؼ�����Ⱦ��ʵ�ֻ�ѧʵ����ɫ����Ҫ��ijѧ�������в�����һ��ʵ�飺��һ���³İ�ֽ�IJ���Ƭ�IJ�ͬλ�÷ֱ�μ�Ũ��Ϊ0.1mol/L ��KBr��KI����������Һ����NaOH������̪����FeCl2����KSCN����Һ��1�Σ�ÿ��Һ�α˴˷ֿ���Χ�ɰ뾶С�ڱ������Բ�Σ���ͼ��ʾ������Բ�Ĵ�����2��֥������С��KMnO4���壬��KMnO4����μ�һ��Ũ���ᣬ��������������Ǻã�����֪��2KMnO4+16HCl��Ũ���T2KCl+2MnCl2+5Cl2��+8H2O���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
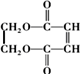 �ĺϳ�·����ͼ��
�ĺϳ�·����ͼ��
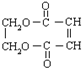 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����

�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com