
【题目】已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=﹣Q1kJmol﹣1
2H2(g)+O2(g)=2H2O(g)ΔH=﹣Q2kJmol﹣1,
2H2(g)+O2(g)=2H2O(l) ΔH2=﹣Q3kJmol﹣1
常温下,取体积比2∶3的甲烷和氢气的混合气体11.2 L(标准状况下),经完全燃烧后恢复至室温,则放出的热量为( )
A.0.4Q1+0.15Q2B.0.2Q1+0.05Q2C.0.2Q1+0.15Q3D.0.2Q1+0.3Q2
【答案】C
【解析】
标准状况下11.2L甲烷和氢气混合气体的物质的量为![]() =0.5mol,甲烷和氢气的体积之比为2:3,所以甲烷的物质的量为:0.5mol×2/5=0.2mol,氢气的物质的量为0.5mol-0.2mol=0.3mol,由CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-Q1 kJ/mol 可知,0.2mol甲烷燃烧放出的热量为0.2mol×Q1 kJ/mol =0.2Q1 kJ,由2H2(g)+O2(g)=2H2O(l)△H3=-Q3 kJ/mol可知,0.3mol氢气燃烧放出的热量为0.3mol/2×Q3 kJ/mol =0.15Q3kJ,所以放出的热量为0.2Q1kJ+0.15Q3kJ=(0.2Q1+0.15Q3)kJ。
=0.5mol,甲烷和氢气的体积之比为2:3,所以甲烷的物质的量为:0.5mol×2/5=0.2mol,氢气的物质的量为0.5mol-0.2mol=0.3mol,由CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H1=-Q1 kJ/mol 可知,0.2mol甲烷燃烧放出的热量为0.2mol×Q1 kJ/mol =0.2Q1 kJ,由2H2(g)+O2(g)=2H2O(l)△H3=-Q3 kJ/mol可知,0.3mol氢气燃烧放出的热量为0.3mol/2×Q3 kJ/mol =0.15Q3kJ,所以放出的热量为0.2Q1kJ+0.15Q3kJ=(0.2Q1+0.15Q3)kJ。
答案选C。


科目:高中化学 来源: 题型:
【题目】认真观察下列装置,回答下列问题:

(1)装置B中PbO2上发生的电极反应方程式为___,盐桥中K+移向___(填“装置B”或“装置C”)。
(2)装置A中总反应的离子方程式为___。
(3)若装置E中的目的是在Cu材料上镀银,则X为___,极板N的材料为___。
(4)装置D中右侧石墨电极反应式为:___;
(5)某种利用垃圾渗透液实现发电、环保二位一体结合的装置示意图如图所示,当该装置工作时,按要求填空:
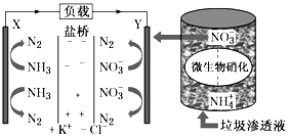
①电流由极___(填“X→Y”或“Y→X”),当电路中流过7.5mol电子时,共产生标准状况下N2的体积为___;
②Y极发生的反应为:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是某同学探究Na2SO3溶液和铬(VI)盐溶液反应规律的实验记录,已知:Cr2O72-(橙色)+ H2O![]() 2CrO42-(黄色)+ 2H+
2CrO42-(黄色)+ 2H+
序号 | a | b | 现象 | |
| 1 | 2 mL 0.05 mol·L1 K2Cr2O7溶液(pH = 2) | 3滴饱和Na2SO3溶液(pH = 9) | 溶液变绿色(含Cr3+) |
2 | 2 mL 0.1 mol·L1 K2CrO4溶液(pH = 8) | 3滴饱和Na2SO3溶液 | 溶液没有明显变化 | |
3 | 2 mL饱和Na2SO3溶液 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变黄色 | |
4 | 2 mL蒸馏水 | 3滴0.05 mol·L1 K2Cr2O7溶液 | 溶液变成浅橙色 |
下列说法不正确的是
A. 实验1中的绿色溶液中含有SO42-
B. 实验1、2的a溶液中所含的离子种类相同
C. 向实验3溶液中继续滴加过量硫酸可使溶液变为浅橙色
D. 实验4的目的是排除稀释对溶液颜色变化造成的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据要求完成下列各小题。
(1)由铜片、锌片和1L0.5mol/L的H2SO4(足量)组成的原电池中,若锌片只发生电化学腐蚀,一段时间后某极产生3.36L(标准状况)的气体。请回答:
①负极是___(填“锌”或“铜”),发生___反应(填“氧化”或“还原”)。

②假设反应后溶液体积不变,反应后溶液的pH为___(用对数表示)。
(2)如图是某燃料电池的示意图,请回答:
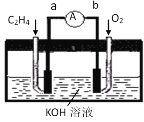
①在导线中电子流动方向为___(用a、b表示)。
②该燃料电池的负极反应式为___。
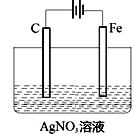
(3)如图是电解未知浓度的硝酸银溶液的示意图,请根据要求答题。
①Fe电极叫做___极,C电极的反应式为___。
②当某电极的固体质量增重21.6g时,整个装置共产生气体(标准状况下)体积2.24L,推断该气体的组成___(包括成分和体积)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积一定的密闭容器中给定物质A、B、C的量,在一定条件下发生反应建立的化学平衡:aA(g)+bB(g)xC(g),符合如图所示的关系(C%表示平衡混合气中产物C的百分含量,T表示温度,p表示压强)。在图中,Y轴是指( )
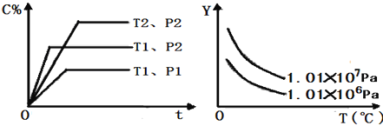
A.反应物A的百分含量B.平衡混合气体中物质B的百分含量
C.平衡混合气体的密度D.平衡混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,将3molA和1molB两种气体混合于固定容积为2L密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g)+2D(s)。2min末该反应达到平衡,生成0.6molD,并测得C的浓度为0.15mol/L。下列判断正确的是
xC(g)+2D(s)。2min末该反应达到平衡,生成0.6molD,并测得C的浓度为0.15mol/L。下列判断正确的是
A. 从开始到平衡A的平均反应速率为0.225mol/(Ls)
B. 从开始到平衡B的转化率为60%
C. 此反应的化学平衡常数表达式K=c(C)c2(D)/c3(A)c(B)
D. 若混合气体的密度不再改变时,该反应一定达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知一定温度下,X(g)+2Y(g) ![]() mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
mZ(g);△H=-akJ/mol(a>0),现有甲、乙两容积相等且固定的密闭容器,在保持该温度下,向密闭容器甲中通入1molX和2molY,达到平衡状态时,放出热量bkJ;向密闭容器乙中通入2molX和4molY,达到平衡状态时,放出热量ckJ,且2b<c,则下列各值关系正确的是
A. a=b B. 2a<c C. m<3 D. m>3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,错误的是( )
A.苯与浓硝酸、浓硫酸共热并保持55-60℃反应生成硝基苯
B.乙苯能发生氧化反应,但不能发生还原反应
C.乙烯与溴的四氯化碳溶液反应生成1,2-二溴乙烷
D.苯乙烯在合适条件下催化加氢可生成乙基环己烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是( )
A. 纯碱溶液去油污 B. 加热氯化铁溶液颜色变深
C. 铁在潮湿的环境中生锈 D. 浓硫化钠溶液有臭味
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com