
| 溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN | C6H5ONa |
| pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 | 11.3 |
| A. | CO2+H2O+2NaClO→Na2CO3+2HclO | |
| B. | HCN+Na2CO3→CO2+2NaCN+H2O | |
| C. | 结合质子能力由强到弱的顺序为:CO32->HCO3->CH3COO- | |
| D. | 常温下电离常数比较:Ki1(H2CO3)>Ki2(H2CO3)>Ki(C6H5OH) |
分析 相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,据此分析解答.
解答 解:A.酸性HCO3-<HClO,所以少量二氧化碳通入NaClO溶液中发生的反应为:NaClO+CO2+H2O=NaHCO3+HClO,故A错误;
B.酸性HCO3-<HCN<H2CO3,所以过量的HCN滴入碳酸钠溶液中发生反应:HCN+Na2CO3=NaCN+NaHCO3,故B错误;
C.酸根离子水解程度越大,其结合质子能力越强,酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,所以酸根离子结合质子能力大小顺序是CO32->CN->HCO3->CH3COO-,故C正确;
D.酸根离子水解程度CO32->C6H5O->CN->ClO->HCO3->CH3COO-,酸的电离平衡常数从小到大顺序是:HCO3-<C6H5OH<HCN<HClO<H2CO3<CH3COOH,故D错误;
故选C.
点评 本题考查了盐类水解,明确酸根离子水解程度与酸的电离平衡常数、相同浓度钠盐溶液pH大小的关系是解本题关键,再结合强酸制取弱酸来分析解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 钢铁的电化学腐蚀和化学腐蚀往往同时发生 | |
| B. | 加入合适的催化剂,能降低反应活化能,从而改变反应的焓变 | |
| C. | 常温下,pH为5的氯化铵溶液和pH为9的醋酸钠溶液中水的电离程度不同 | |
| D. | 向BaSO4沉淀中加入饱和Na2CO3溶液后生成BaCO3,则Ksp(BaCO3)<Ksp(BaSO4) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaAlO2溶液中加入适量的稀硫酸后,蒸干并灼烧 | |
| B. | 向NaAlO2溶液中通入过量的CO2后,过滤并灼烧 | |
| C. | 向AlCl3溶液中加入适量的NaAlO2溶液后,蒸干并灼烧 | |
| D. | 向AlCl3溶液中加入过量的NaOH溶液后,过滤并灼烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 加入试剂 | 稀硫酸 | 浓硫酸、加热 | 稀硝酸 | 浓硝酸 |
| 实验现象 | 红色固体和蓝色溶液 | 无色气体和蓝色溶液 | 无色气体和蓝色溶液 | 红棕色气体和蓝色溶液 |
| A. | Cu | B. | Cu2O | ||
| C. | 一定有Cu,可能有Cu2O | D. | 一定有Cu2O,可能有Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
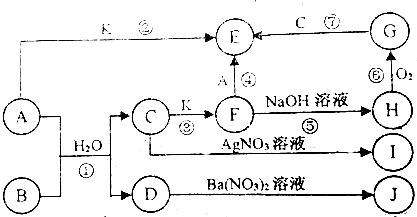
| 实验步骤 | 实验现象 | 用化学用语解释 |
| 将少量气体通入淀粉KI溶液 | 溶液最初变成 蓝 | Cl2+2I-=I2+2Cl- |
| 继续通入气体 | 溶液逐渐变成无色 | 5Cl2+I2+6H2O=2HIO3+10HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
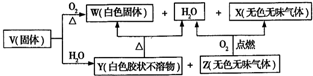
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com