
| C | ||
| A | R | B |
| D |
| A. | 4 Z | B. | 4 Z+10 | C. | 4 Z+5 | D. | 4 Z+14 |
分析 如果R第三周期Mg元素,D和R原子序数相差8,C和R原子序数相差8;
如果R是第三周期第IIIA族到第VIIA族元素,D和R原子序数相差18,C和R原子序数相差8;
如果R是第四周期Ca元素,C和R原子序数相差8,D和R原子序数相差18;
如果R是第四周期第IIIA族到第VIIA族元素,C和R原子序数相差18、R和D原子序数相差18;
如果这几种元素都是副族元素,且R是第五周期第IVB族到第VIII族、第IB族时,C和R原子序数相差18、R和D原子序数相差32.
解答 解:如果R第三周期Mg元素,D和R原子序数相差8,C和R原子序数相差8,则A、B、C、D四种元素的原子序数之和为4Z;
如果R是第三周期第IIIA族到第VIIA族元素,D和R原子序数相差18,C和R原子序数相差8,则A、B、C、D四种元素的原子序数之和为4Z+10;
如果R是第四周期Ca元素,C和R原子序数相差8,D和R原子序数相差18,则A、B、C、D四种元素的原子序数之和为4Z+10;
如果R是第四周期第IIIA族到第VIIA族元素,C和R原子序数相差18、R和D原子序数相差18,A、B、C、D四种元素的原子序数之和为4Z;
如果这几种元素都是副族元素,且R是第五周期第IVB族到第VIII族、第IB族时,C和R原子序数相差18、R和D原子序数相差32,则A、B、C、D四种元素的原子序数之和为4Z+14,
通过以上分析知,A、B、C、D四种元素原子序数之和不可能为4Z+5,
故选C.
点评 本题考查元素的位置及应用,为高频考点,把握元素的位置、原子序数的关系为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
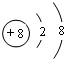 .
.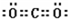 .
.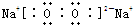 ,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程:
,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程: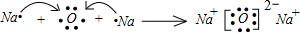 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | |
| B. | CH2=CH2+Br2→BrCH2CH2Br | |
| C. | CH3CH2CH2Cl+NaOH $→_{△}^{酸}$CH3CH=CH+NaCl+H2O | |
| D. | 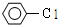 +H2O$→_{△}^{酸}$ +H2O$→_{△}^{酸}$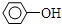 +HCl +HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应中旧键断裂吸收的总能量大于新键形成放出的总能量 | |
| B. | 反应物的总能量高于生成物的总能量 | |
| C. | 该反应为放热反应 | |
| D. | 该反应的化学能可以转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 负极反应为:14H2O+7O2+28e-=28OH- | |
| B. | 放电一段时间后,负极周围的pH升高 | |
| C. | 放电过程中OH-向正极移动 | |
| D. | 每消耗1mol C2H6,则电路上转移的电子为14mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素周期律是按相对原子质量逐渐增大的顺序从左到右排列的 | |
| B. | 最外层电子数相同的元素都是同一族 | |
| C. | 同周期元素原子的电子层数相同数一定相同 | |
| D. | 非金属元素的最外层电子数都大于或等于4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
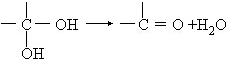
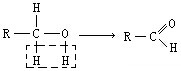
 (在方框中填写有机物的结构简式,说明加氧氧化)
(在方框中填写有机物的结构简式,说明加氧氧化)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
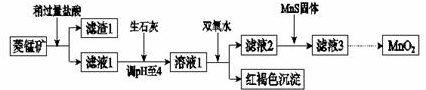
| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
 纸置于阳极附近,若试纸变蓝则证明有Cl2生成.
纸置于阳极附近,若试纸变蓝则证明有Cl2生成.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com